Болезнь помпе у детей симптомы и лечение
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 1 июня 2018;
проверки требуют 4 правки.
Боле́знь По́мпе (генерализо́ванный гликогено́з, гликогеноз II типа) — редкое наследственное заболевание с аутосомно-рецессивным механизмом наследования[1], связанное с повреждением мышечных и нервных клеток по всему организму. Клиническая картина данной патологии обусловлена накоплением гликогена в лизосомах, вызванным недостаточностью лизосомного фермента — кислой α-1,4-глюкозидазы. Различают быстро прогрессирующую (классическую) и медленно прогрессирующую формы болезни Помпе. Несмотря на широкий спектр клинических проявлений гликогеноза II типа, в основе всех форм болезни лежит дефицит одного фермента, кодируемого геном GAA.
Историческая справка[править | править код]
Данное заболевание было впервые описано в 1932 году голландским патологом И. К. Помпе[2][3]. В 1963 году бельгийский биохимик Генри Хэрс обнаружил у пациентов с этой болезнью недостаточность лизосомного фермента α-глюкозидазы[4]. Болезнь Помпе является первым наследственным заболеванием, идентифицированым как лизосомная болезнь накопления, которых сейчас описано около 50[5].
Эпидемиология[править | править код]
Распространённость болезни Помпе (гликогеноза II-го типа, англ. GSD II) составляет примерно 1 случай на 140 000 (классическая инфантильная форма) и 1 на 60 000 взрослого населения (болезнь Помпе с поздним началом)[6]. Заболевание встречается практически во всех этнических группах населения.
Наследование[править | править код]
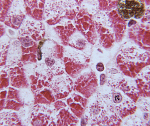
Аутосомно-рецессивный механизм наследования болезни Помпе: оба родителя являются носителями дефектного гена (помечен красным кружочком). По законам Менделя вероятность рождения больного ребёнка составляет 25 %.
Заболевание наследуется по аутосомно-рецессивному типу и, таким образом, с одинаковой частотой встречается как у мужчин, так и у женщин.
Ген GAA, мутации в котором вызывают данное заболевание, локализован на аутосоме (хромосоме 17). Заболевание клинически манифестирует только в случае, когда обе аутосомы, полученные по одной от отца и матери, являются дефектными по данному гену. Как и во всех случаях аутосомно-рецессивного наследования, если оба родителя несут дефектный ген, то вероятность наследования болезни у потомства составляет 1 из 4. На схеме синим цветом обозначены здоровые, фиолетовым — носители дефектного гена, красным — болезнь Помпе (два дефектных гена одной аллели 17q25.2-3). Синим кружочком помечен нормальный ген, красным — дефектный.
Патогенез[править | править код]
Генетический дефект локуса 17q25.2-3 хромосомы (ген GAA) ведёт к дефициту кислой α-1,4-глюкозидазы (мальтазы) — одного из ферментов лизосом. В свою очередь дефект этого фермента вызывает прогрессирующее накопление гликогена, которое со временем может стать причиной необратимого поражения мышц и стать причиной смертельного исхода.
Диагностика[править | править код]
Диагноз данной редкой наследственной патологии верифицируется на основании лабораторного исследования степени активности фермента — кислой α-1,4-глюкозидазы (мальтазы) в крови (метод «сухого пятна»)[7] или тканях организма (кожных фибробластах, мышечной ткани, лейкоцитах).
Заболевание в встречается в различных клинических формах:
- классическая (инфантильная) форма болезни Помпе и
- болезнь Помпе с поздним началом (в детском, подростковом возрасте и у взрослых).
Этапы диагностического поиска[править | править код]
Классическая (инфантильная) форма:
- этап: выявление группы риска.
- основные клинические проявления:
- выраженная мышечная гипотония (синдром «вялого ребёнка»);
- задержка моторного развития;
- частые инфекционные заболевания верхних дыхательных путей (ОРЗ);
- наличие признаков дыхательной недостаточности;
- расстройства дыхания во сне;
- кардиомегалия в сочетании с кардиомиопатией;
- сердечная недостаточность;
- макроглоссия;
- гепатомегалия;
- спленомегалия;
- гипотрофия
- лабораторная диагностика: повышение уровня креатинфосфокиназы, лактатдегидрогеназы, АлАТ, АсАТ в сыворотке крови.
- инструментальные методы диагностики:
- поиск наличия признаков поражения миокарда и/или сердечного ритма;
- ЭКГ;
- ЭхоКГ;
- МРТ;
- рентгенография органов грудной полости
- основные клинические проявления:
- этап: специфическая диагностика.
- диагностика: для всех пациентов группы риска болезни Помпе — биохимический анализ активности кислой мальтазы в крови методом сухих пятен
- верификация: повторное измерение уровня активности кислой мальтазы в крови альтернативным методом (например, определение активности этого фермента в лейкоцитах периферической крови)
- этап: дополнительные методы диагностики.
- при наличии типичной клинической картины на фоне «нормальной» активности кислой мальтазы в крови показано проведение ДНК-диагностики дефектного гена (GAA).
- морфологический анализ мышечной ткани (биопсия) позволяет выявить специфические изменения, однако их отсутствие не исключает наличия болезни Помпе.
Диагностический алгоритм болезни Помпе с поздним началом:
- этап: выявление группы риска.
- основные клинические проявления:
- прогрессирующая мышечная слабость тазового и плечевого пояса (на начальных стадиях болезни преобладает слабость в ногах);
- затруднение при ходьбе, подъёме по лестнице, вставании из положения сидя;
- боли в мышцах;
- дыхательная недостаточность;
- ортопноэ;
- частые инфекционные заболевания дыхательных путей;
- дневная сонливость;
- головная боль по утрам;
- ночная гиповентиляция лёгких;
- снижение массы тела у детей и подростков;
- гипотрофия
- лабораторная диагностика: повышение уровня креатинфосфокиназы, лактатдегидрогеназы, АлАТ, АсАТ в сыворотке крови.
- инструментальные методы диагностики:
- выявление миопатического паттерна в ходе проведения миографии скелетных мышц конечностей;
- выявление расстройств дыхания во время сна (эпизоды апноэ и снижение степени оксигенации крови) в ходе проведения полисомнографии;
- выявление значительной разницы результатов измерения форсированной жизненной ёмкости лёгких (ФЖЕЛ) в положении лежа и сидя более, чем на 10 % от исходной величины ФЖЕЛ — ранний признак специфического поражения диафрагмы при болезни Помпе.
- основные клинические проявления:
- этап: специфическая диагностика.
- диагностика: для всех пациентов группы риска болезни Помпе — биохимический анализ активности кислой мальтазы в крови методом сухих пятен
- верификация: повторное измерение уровня активности кислой мальтазы в крови альтернативным методом (например, определение активности этого фермента в лейкоцитах периферической крови)
- этап: дополнительные методы диагностики.
- при наличии типичной клинической картины на фоне «нормальной» активности кислой мальтазы в крови показано проведение ДНК-диагностики дефектного гена (GAA).
- морфологический анализ мышечной ткани (биопсия) позволяет выявить специфические изменения, однако их отсутствие не исключает наличия болезни Помпе.
Клиническая картина[править | править код]
Накопление гликогена ведёт к развитию прогрессирующей мышечной слабости (миопатии). В патологический процесс вовлекаются различные органы и ткани макроорганизма: сердце, скелетные мышцы, печень и нервная система.
Встречаются исключения, однако уровень активности кислой α-1,4-глюкозидазы определяет форму гликогеноза II типа (англ. GSD II). В зависимости от возраста, в котором начинают проявляться клинические симптомы, выделяют две формы заболевания: классическую (или инфантильную) и болезнь Помпе с поздним началом — симптомы появляются позже и прогрессируют медленнее[8].
Классическая (инфантильная) форма[править | править код]
Начало клинических проявлений классической формы болезни, как правило, диагностируется в возрасте 4—8 месяцев. Обращает внимание задержка моторного развития ребёнка грудного возраста. При этом внешне мышцы ребёнка выглядят нормально, однако они вялые и слабые: ребёнок плохо держит голову, практически не переворачивается со спины на живот и обратно. По мере прогрессирования заболевания утолщается сердечная мышца и снижается её сократительная способность. Без лечения смерть обычно наступает в результате сердечной недостаточности и слабости дыхательных мышц[8].
Болезнь Помпе с поздним началом[править | править код]
Развитие клинической картины формы гликогеноза II-го типа с поздним началом происходит позже (в возрасте 1—2 лет), прогрессирует медленнее классической (инфантильной) формы. Одним из первых симптомов является прогрессирующее снижение силы мышц. Оно начинается с ног и распространяется на мышцы туловища и рук, в том числе диафрагму и другие мышцы, участвующие в акте дыхания. Наиболее распространённой причиной смерти является дыхательная недостаточность. В некоторых случаях отмечается увеличение размеров сердечной мышцы и наблюдаются нарушения сердечного ритма, однако это не относится к постоянным признакам данного заболевания[8].
Дифференциальная диагностика[править | править код]
К сожалению, диагноз устанавливается с задержкой, поскольку признаки и симптомы заболевания весьма похожи на проявления других болезней. Тем не менее, ранняя диагностика и специфическое лечение крайне необходимы для улучшения состояния пациента.
Дифференциальная диагностика гликогеноза II-го типа проводится:
- с другими лизосомными болезнями накопления: синдром Данона;
- с другими гликогенозами;
- с другими заболеваниями: полиомиозит, мышечная дистрофия Беккера — Дюшена, идиопатическая гипертрофическая кардиомиопатия, конечностно-поясная мышечная дистрофия.
Лечение[править | править код]
Существующие на сегодняшний день лечебные стратегии могут улучшить качество жизни пациентов с гликогенозом II-го типа, однако они не способны изменить течение болезни. Раннее начало терапии чрезвычайно важно для достижения наибольшего эффекта.
Единственный вариант специфического лечения заболевания — терапевтическое замещение повреждённого либо отсутствующего фермента фармацевтическим препаратом «Майозайм» (альглюкозидаза альфа, rhGAA). Данный препарат разработан компанией «Genzyme Corp.» и успешно прошёл клинические испытания, в которых участвовало 39 больных в возрасте от 1 месяца до 3.5 лет. В 2006 году он был одобрен FDA для лечения пациентов с инфантильной формой болезни в США[9]. Препарат «Майозайм» относится к одним из самых дорогих лекарств в мире, и годовой курс обходится от 100 до 300 тысяч долларов США в зависимости от возраста и веса пациента[10]. C 2013 года препарат зарегистрирован в РФ[11].
Прогноз[править | править код]
Прогноз данного редкого генетически детерминированного заболевания варьирует в зависимости от времени наступления и степени выраженности клинических симптомов. Без своевременного специфического лечения эта генетическая патология, особенно среди младенцев и маленьких детей, часто заканчивается летально.
См. также[править | править код]
- Гликогенозы
- Лизосомные болезни накопления
- Паренхиматозные дистрофии
- Помпе, Иоанн Кассианус
Примечания[править | править код]
- ↑ Pompe disease at NLM Genetics Home Reference (англ.)
- ↑ Pompe, J.C. Over idiopathische hypertrophie van het hart (нид.) // Nederlands Tijdschrift voor Geneeskunde (англ.)русск.. — 1932. — Bd. 76. — P. 304—312. (англ.)
- ↑ of Glycogen-Storage Disease Type II (Pompe Disease) 947870, раздел Genetics of Glycogen-Storage Disease Type II (Pompe Disease) (англ.) на сайте EMedicine
- ↑ Hers H. G. α-Glucosidase deficiency in generalized glycogen-storage disease (Pompe’s disease) (англ.) // Biochemical Journal. — 1963. — Vol. 86, no. 1. — P. 11—16. — PMID 13954110.
- ↑ la Marca G. Lysosomals // Physician’s Guide to the Diagnosis, Treatment, and Follow-Up of Inherited Metabolic Diseases / N. Blau, M. Duran, K. M. Gibson, C. D. Vici. — Springer Berlin Heidelberg, 2014. — P. 785-793. — ISBN 978-3-642-40336-1. (англ.)
- ↑ Ausems M.G., Verbiest J., Hermans M.P., et al. Frequency of glycogen storage disease type II in The Netherlands: implications for diagnosis and genetic counselling (англ.) // European Journal of Human Genetics (англ.)русск. : journal. — 1999. — September (vol. 7, no. 6). — P. 713—716. — doi:10.1038/sj.ejhg.5200367. — PMID 10482961. (англ.)
- ↑ Umapathysivam K., Hopwood J.J., Meikle P. J. Determination of acid alpha-glucosidase activity in blood spots as a diagnostic test for Pompe disease. Clin. Chem. 2001; 47; 1378—1383. (англ.)
- ↑ 1 2 3 Type II Glycogen Storage Disease (недоступная ссылка). The Association for Glycogen Storage Disease. Дата обращения 27 ноября 2014. Архивировано 23 июня 2012 года. (англ.)
- ↑ FDA Approves First Treatment for Pompe Disease (англ.). U.S. Food and Drug Administration (28 April 2006). Дата обращения 15 апреля 2015.
- ↑ Matthew Herper. The World’s Most Expensive Drugs (англ.). Forbes.com LLC (22 February 2010). Дата обращения 15 апреля 2015.
- ↑ Государственный реестр лекарственных средств. grls.rosminzdrav.ru. Дата обращения 14 января 2016.
Ссылки[править | править код]
- Русскоязычная пациентская группа о болезни Помпе и миопатиях
- Лизосомные болезни накопления
Источник

Болезнь Помпе – редкая наследственная патология, одна из форм лизосомных болезней накопления, характеризующаяся нарушением процессов расщепления гликогена в нервных и мышечных клетках (скелетные мышцы, миокард). Симптомы заболевания довольно вариабельны по времени своего проявления и выраженности у разных больных, традиционно наблюдается прогрессирующая мышечная слабость, при некоторых формах – кардиомегалия с дилятационной кардиомиопатией. Диагностика болезни Помпе производится на основании данных наследственного анамнеза, гистологического и гистохимического изучения мышечных тканей, биохимического анализа крови, а также генетических исследований. Лечение в настоящий момент может производиться с помощью фермент-заместительной терапии, однако эффективность этой методики неодинакова у разных пациентов.
Общие сведения
Болезнь Помпе (гликогеноз 2-го типа, недостаточность кислой альфа-глюкозидазы) – наследственное заболевание, при котором из-за нарушения процессов обмена гликогена происходит повреждение нервных и мышечных тканей. Впервые было описано в 1932 году голландским ученым И. Помпе, с тех пор официально зарегистрировано более 50 случаев патологии. Болезнь Помпе с равной степенью вероятности поражает как мужчин, так и женщин, встречаемость колеблется от 1:60000 (взрослая форма) до 1:140000 (ранняя, или инфантильная форма). Является одной из немногих лизосомных болезней накопления, в отношении которой было разработано эффективное специфическое лечение, одобренное в США в 2006 году и в России – в 2013 г. Однако стоимость этиотропной терапии болезни Помпе крайне высока и составляет несколько сотен тысяч долларов в год. Смертность в случае отсутствия лечения зависит от формы патологии – детская инфантильная форма часто приводит к летальному исходу на 1-2-м году жизни ребенка, при типе болезни с отсроченным началом нарастание симптомов идет намного медленнее.
Болезнь Помпе
Причины болезни Помпе
Болезнь Помпе является классическим гликогенозом, при ней в тканях скелетных мышц, миокарда и отчасти нервной системы формируются отложения гликогена по причине невозможности его расщепления. Это происходит в результате мутации гена GAA, расположенного на 17-й хромосоме – он кодирует последовательность кислой альфа-1,4-глюкозидазы или мальтазы. Это один из ключевых ферментов лизосом, участвующий в расщеплении молекулы гликогена на более простые отрезки, которые, в конечном итоге, деградируют до глюкозы, вступающей в энергетический обмен клетки. Так как гликоген является важным депо энергии для таких структур, как скелетные мышцы, миокард, печень и нервная ткань, проявления болезни Помпе сводятся именно к патологическим изменениям данных органов.
В результате подобных изменений сначала возникает дефицит энергии в клетках – потребности тканей в глюкозе покрываются только за счет ее поступления из крови. Кроме того, в лизосомах при болезни Помпе начинает накапливаться гликоген, формируя крупные включения в виде вакуолей, в дальнейшем приводя к дистрофии и повреждению клеток. Наследование дефектных вариантов гена GAA происходит по аутосомно-рецессивному типу. Наличие нескольких форм заболевания предположительно объясняется разными типами мутаций вышеуказанного гена. Возможно, при некоторых дефектах происходит не полное исчезновение, а лишь снижение активности кислой альфа-1,4-глюкозидазы, что и приводит к более позднему развитию болезни Помпе и медленному прогрессированию заболевания. Определение формы патологии играет важную роль для составления ее прогноза и схемы лечения.
Классификация болезни Помпе
На сегодняшний день специалисты выделяют несколько основных форм болезни Помпе, основное различие между которыми заключается в сроках начала заболевания и выраженности симптомов. В большинстве случаев, с гликогенозом 2-го типа сталкиваются врачи-педиатры, однако имеется тип заболевания, выявляемый у взрослых.
- Ранняя инфантильная форма – такая разновидность болезни Помпе считается наиболее тяжелой. Выявляется еще на первых месяцах жизни, симптомы миопатии, поражения печени (гепатомегалия) и сердца (кардиомиопатия) достаточно быстро прогрессируют. Обычно больные с ранней инфантильной формой болезни Помпе умирают от сердечной или дыхательной недостаточности в возрасте до года.
- Поздняя инфантильная форма – первые симптомы возникают в возрасте 1-3 года, скорость их прогрессирования также намного медленнее. При данном типе болезни Помпе наиболее выражены поражения миокарда, смерть наступает к подростковому возрасту от сердечной недостаточности.
- Ювенильная форма болезни Помпе развивается в возрасте 6-10 лет. Так же, как и в предыдущем варианте, основным органом-мишенью болезни становится сердце, смерть от нарастающей сердечной недостаточности наступает к 20 годам.
- Взрослая форма болезни Помпе – манифестация симптомов происходит в 20-40 лет. Ведущим симптомом является медленно прогрессирующая миопатия, поражения печени практически никогда не регистрируются, в некоторых случаях возможны незначительные нарушения миокарда. При этом типе болезни Помпе больные во многих случаях доживают до старости, лишь иногда возможен более ранний летальный исход из-за дыхательной или сердечной недостаточности.
Методами современной генетики на сегодняшний момент не определена взаимосвязь между отдельными типами мутаций гена GAA и формами болезни Помпе. Возможно, причина такой вариабельности проявлений лежит совсем в другом – в литературе описаны семейные случаи заболевания, когда у родственников регистрировались различные формы патологии. Изучение закономерностей, приводящих к развитию болезни Помпе определенного типа, сильно осложняется относительной редкостью данного синдрома.
Симптомы болезни Помпе
Проявления болезни Помпе довольно сильно отличаются при различных формах заболевания. Ранний инфантильный тип характеризуется выраженной мышечной слабостью младенца, снижением его двигательной активности, плаксивостью. В педиатрии при осмотре такого больного часто выявляется задержка психомоторного развития, различная степень увеличения печени, пальпация иногда выявляет гипертрофию мышц, которые, однако, при этом довольно слабые. При дальнейшем развитии болезни Помпе возникают проблемы с кормлением из-за слабости сосательной мускулатуры, выявляется дисфагия и, как итог всего этого – гипотрофия. Нарастающая кардиомиопатия и слабость дыхательной мускулатуры со временем приводят к смерти ребенка.
Поздняя инфантильная и ювенильная формы болезни Помпе протекают практически одинаково, различается только срок появления симптомов патологии. Как правило, выявляется мышечная слабость, признаки кардиомиопатии. Со временем начинает формироваться выраженная дистрофия скелетной мускулатуры, кардиомегалия, на этом фоне начинают увеличиваться печень и селезенка. Длительность течения этих форм болезни Помпе составляет около 10-12 лет, после чего, при отсутствии лечения, наступает летальный исход из-за декомпенсированной сердечной недостаточности. Косвенным симптомом будет являться большая частота простудных заболеваний с легочными осложнениями, ночное апноэ, головные боли по утрам.
Взрослая форма болезни Помпе характеризуется поздним началом (первые проявления возникают в 20-40 лет). Клинически раньше всего обнаруживается дистальная миопатия, проявляющаяся слабостью мышц конечностей. Со временем развиваются искривления позвоночника (сколиоз, лордоз), обусловленные слабостью окружающего позвоночный столб мышечного футляра. В некоторых случаях регистрируются медленно нарастающие признаки сердечной недостаточности, но при болезни Помпе такого типа поражение сердца возникает не всегда. Течение взрослой формы патологии занимает несколько десятилетий, поэтому в ряде случаев больные доживают до старости при приемлемом качестве жизни и без специфического лечения.
Диагностика болезни Помпе
Выявление болезни Помпе можно производить многочисленными клиническими методиками – биохимическим анализом крови, изучением биоптата мышц, культур фибробластов или лейкоцитов больного, традиционными исследованиями (осмотр, ЭКГ, ЭхоКГ). При осмотре часто обнаруживается слабость и дистрофия мышц, при вовлечении в патологический процесс внутренних органов – гепато- и спленомегалия. На электрокардиограмме регистрируется укорочение интервала PQ, расширение комплекса QRS, обусловленного увеличением размеров миокарда. По этой же причине увеличивается длительность фазы реполяризации желудочков, что проявляется инверсией зубца T. Эхографическое исследование сердца показывает резкое увеличение его размеров за счет значительного утолщения стенок желудочков. При взрослой форме болезни Помпе вышеуказанные изменения миокарда могут не выявляться.
Биохимический анализ крови позволяет обнаружить как специфические, так и косвенные признаки заболевания. Специфическим исследованием будет определение активности кислой альфа-1,4-глюкозидазы в плазме крови, которая при болезни Помпе будет резко снижена. Косвенным указанием на наличие патологии является резкое повышение активности креатинфосфокиназы, обусловленное поражением мышечной ткани. Гистологическое исследование биоптата мышц выявляет в миоцитах многочисленные включения гликогена, часто придающие им вид «пенистых клеток». Гистохимическое изучение при болезни Помпе выявляет резкое снижение активности кислой альфа-1,4-глюкозидазы в мышечной ткани, фибробластах и лейкоцитах.
Врачом-генетиком может быть проведено генетическое определение болезни Помпе – оно производится методом прямого секвенирования последовательности гена GAA с целью выявления дефектных участков. Кроме того, может помочь в диагностике заболевания и составление наследственного анамнеза. Генетическая диагностика болезни Помпе включает в себя секвенирование GAA и у фенотипически здоровых родственников больного с целью выявления носительства патологического гена.
Лечение и прогноз болезни Помпе
На сегодняшний день единственным методом специфического лечения болезни Помпе является фермент-заместительная терапия с целью восполнения дефицита кислой альфа-1,4-глюкозидазы. Для этого используют препарат альфа алглюкозидазы производства США. Стоимость этого лечения крайне высока (годовой курс стоит 100-400 тысяч долларов), однако его эффективность неодинакова у разных больных. Других способов лечения болезни Помпе в настоящее время не существует. Без лечения при инфантильных и ювенильной формах заболевания прогноз неблагоприятный, у взрослого типа – неопределенный. Профилактика возможна только путем своевременного выявления носительства болезни Помпе (в случае наличия патологии у кровных родственников) и последующей генетической пренатальной диагностики.
Источник
