Что такое болезнь крона и гиршпрунга

Болезнь Гиршпрунга — это врожденная патология толстой кишки с недоразвитием или отсутствием нервных сплетений в подслизистом и мышечном слоях всего толстого кишечника или его сегмента. Проявляется хроническими запорами, отсутствием позывов к дефекации, метеоризмом, нелокализованной абдоминальной болью, асимметричной формой живота, интоксикацией. Диагностируется с помощью ирригоскопии, ректороманоскопии, гистологии биоптата толстокишечной стенки, аноректальной манометрии. Лечится хирургическими методами, пациентам рекомендована одномоментная или двухэтапная резекция толстого кишечника с созданием колоректального анастомоза.
Общие сведения
Аганглиоз толстого кишечника (врожденный мегаколон) — одна из частых аномалий развития пищеварительных органов. По данным наблюдений, распространенность болезни Гиршпрунга в популяции новорожденных составляет от 1:30 000 до 1:2 000. У 90% пациентов заболевание дебютирует до 10-летнего возраста. У мальчиков аномалия выявляется в 4,32 раза чаще, чем у девочек. В 29,0-32,7% случаев патология ассоциирована с другими пороками развития, при этом у 9% больных толстокишечный аганглиоз развивается в рамках синдрома Дауна. Впервые нарушение было описано в трудах датского педиатра Гаральда Гиршпрунга в 1888 году. Актуальность своевременного выявления заболевания обусловлена тяжестью его осложнений.
Болезнь Гиршпрунга
Причины
Болезнь Гиршпрунга имеет полиэтиологическое происхождение, роль предполагающих и производящих факторов, способствующих развитию аганглиоза толстокишечной стенки, продолжает уточняться. Вероятнее всего, врожденный порок становится результатом критического повреждения генов, регулирующих формирование толстокишечных нервных структур. По мнению специалистов в области практической проктологии, возникновению аномалии Гиршпрунга способствуют:
- Отягощенная наследственность. У 20% пациентов прослеживается семейный характер болезни. По результатам молекулярно-генетических исследований, при наследуемых мутациях генов RET, GDNF, EDN3, ENDRB нарушается миграция нейробластов из вагусного нейрогребешка, из-за чего возникает аганглиоз стенки кишечника. В 12% случаев болезни прослеживаются хромосомные аберрации, в 18% — порок проявляется в структуре наследственных синдромов.
- Дизонтогенез. Ненаследственные формы болезни связаны с влиянием внутриутробной вирусной инфекции, высокой радиации, мутагенных химических веществ, нарушающих дифференцировку нейробластов. Риск развития аномалии повышается при акушерской патологии и хронических заболеваниях беременной, сопровождающихся тканевой гипоксией, — гестозах, кардиопатологии (гипертонической болезни, сердечной недостаточности), сахарном диабете.
Патогенез
Развитие болезни Гиршпрунга обусловлено нарушением эмбриогенеза предположительно на 7-12 неделях гестационного срока, когда формируются нервные сплетения Мейснера (в подслизистом слое толстой кишки) и Ауэрбаха (в мышечной оболочке кишечника). Из-за преждевременного прекращения миграции нейробластов или их недостаточной дифференцировки вместо типичных подслизистого и мышечно-кишечного сплетений с ганглиями нейроструктуры кишки представлены отдельными нервными волокнами и глиальными элементами.
Чем раньше завершается миграция нейробластов, тем более протяженным является аганглиозный участок толстокишечной стенки. В слизистом слое накапливается ацетилхолинэстераза, которая вызывает спазм кишки, что является патогномоничным признаком аномалии Гиршпрунга. Из-за тонического спазмирования и отсутствия перистальтики денервированный сегмент становится функциональным препятствием для продвижения каловых масс. Хроническая задержка кишечного содержимого приводит к постоянным запорам и значительному расширению вышележащего отдела кишечника.
Классификация
Систематизация болезни Гиршпрунга проводится с учетом анатомических и клинических критериев. В зависимости от локализации аганглиозного участка различают наиболее распространенную ректосигмодиальную форму заболевания, выявляемую у 70% больных, ректальную (до 25% случаев аномалии), субтотальную (3%), сегментарную (1,5%), тотальную (0,5%). По расположению расширенной кишки выделяют мегаректум, мегасигму, левосторонний, субтотальный и тотальный мегаколон, мегаилеум. При диагностике кишечного аганглиоза Гиршпрунга учитывают особенности клинического течения:
- Детский вариант болезни. Выявляется почти у 90% больных. Характеризуется быстрым развитием, практически полным отсутствием самостоятельной дефекации, нарастанием признаков кишечной непроходимости. Хирургическое вмешательство обычно выполняется двухэтапно.
- Пролонгированный вариант аганглиоза. Дебютирует у детей. В связи с небольшой протяженностью денервированного сегмента развивается медленно. Для коррекции запора длительно применяются клизмы. Возможно проведение как двухэтапной, так и одноэтапной операции.
- Латентный вариант аномалии. Запоры появляются в подростковом возрасте, при этом быстро происходит формирование хронической толстокишечной непроходимости. Для устранения запора необходимы ежедневные клизмы. Пассаж каловых масс обычно восстанавливается в два этапа.
При компенсированном течении самостоятельный стул сохраняется много лет, по мере развития заболевания возникают 3-7-дневные запоры, для разрешения которых требуются слабительные или клизма. У больных с субкомпенсированным состоянием запоры без назначения слабительных и клизм длятся более 7 дней. О декомпенсации болезни свидетельствует отсутствие самостоятельной дефекации и позывов к ней, уплотнение кишечного содержимого и формирование каловых камней, неэффективность консервативных методов опорожнения кишечника.
Симптомы болезни Гиршпрунга
Скорость развития клинической картины заболевания зависит от распространенности поражения кишечника. В большинстве случаев первые признаки возникают сразу после рождения ребенка, но иногда патология протекает малосимптомно, дебют наблюдается уже в подростковом и даже взрослом возрасте. Основное проявление толстокишечного аганглиоза — хронические запоры и отсутствие позывов на дефекацию. У 50% больных отмечается вздутие и боли в абдоминальной полости, которые связаны с задержкой стула.
При длительном течении болезни формируется асимметрия живота и расширение кожной венозной сети. У некоторых пациентов можно заметить активную кишечную перистальтику. При аганглиозе Гиршпрунга зачастую возникают признаки анемии — бледность кожи и слизистых, частые головокружения, снижение работоспособности. Могут отмечаться симптомы общей интоксикации организма: тошнота и рвота, головные боли. Патология иногда сочетается с врожденной гетерохромией (неодинаковой окраской радужки глаз).
Осложнения
В случае аганглиоза Гиршпрунга у больных нарушается переваривание и всасывание питательных веществ, что в комбинации со снижением аппетита приводит к резкой гипотрофии вплоть до кахексии. Зачастую обнаруживается железодефицитная анемия. У детей наблюдается отставание в росте и физическом развитии. Длительный застой кала в кишке провоцирует дисбактериоз, воспалительные изменения слизистой оболочки, что может проявляться парадоксальными поносами.
Наиболее опасные осложнения болезни Гиршпрунга — кишечная непроходимость, пролежень стенки каловым камнем и перфорация кишки. Возможно возникновение токсического мегаколона, для которого характерно расширение проксимального отдела кишечника и избыточный рост патогенной бактериальной флоры. Это состояние часто приводит к перитониту и сепсису вследствие проникновения кишечных бактерий через патологически измененную стенку кишечника. В таком случае возникают резкие разлитые боли в животе, многократная рвота, фебрильная лихорадка.
Диагностика
Заподозрить болезнь Гиршпрунга можно при наличии характерных физикальных признаков (пальпации тестоватой «опухоли» и появлении «симптома глины» — четко определяемых через переднюю стенку живота следов сдавления толстой кишки пальцами). Диагностический поиск предполагает проведение комплексного лабораторно-инструментального обследования больного, позволяющего верифицировать диагноз. Наиболее информативными в диагностике аганглиоза являются:
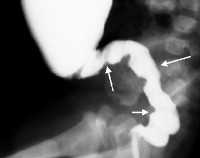
- Ретроградная рентгенография толстого кишечника. Обратное заполнение толстой кишки рентгеновским контрастом дает возможность визуализировать четкий переход между расширенным проксимальным отделом кишечника и суженным дистальным, который не имеет иннервации. При ирригоскопии также определяется отсутствие толстокишечной гаустрации.
- Эндоскопическое исследование прямой и сигмовидной кишки. Ректороманоскопия и ректосигмоскопия проводится без специальной подготовки пациента. При патологии Гиршпрунга выявляется спазмированная кишечная стенка, отсутствие каловых масс. Проксимальнее расположен расширенный участок толстого кишечника, заполненный твердым калом.
- Цитоморфологический анализ по Свенсону. Гистология биоптатов прямой и толстой кишки — «золотой стандарт» в диагностике болезни. Для получения достоверных результатов забор биологического материала осуществляют по задней стенке кишечника на протяжении 6 см, начиная от зубчатой линии. Дополнительно проводят оценку активности АХЭ.
- Манометрическое исследование. Для аганглиоза Гиршпрунга характерно отсутствие рефлекторного раскрытия сфинктера прямой кишки в ответ на повышение давления. Отмечается дискоординация сокращения сфинктеров и прямой кишки. Аноректальная манометрия является важным диагностический критерием и имеет чувствительность около 85%.
Изменения в клиническом анализе крови (лейкоцитоз, повышение СОЭ, токсическая зернистость нейтрофилов) возникают в случае осложненного варианта болезни. В биохимическом анализе крови наблюдается гипоальбуминемия, диспротеинемия. При наличии у пациента парадоксальных поносов проводят бактериологическое исследование кала для выделения патогенных возбудителей.
Аганглиоз Гиршпрунга, прежде всего, необходимо дифференцировать с идиопатическим мегаколоном. Основным диагностическим критерием является отсутствие в биоптатах кишечника подслизистых и межмышечных нервных ганглиев. Обращают внимание на анамнез (начало болезни в раннем детском возрасте), данные исследования активности АХЭ и аноректальной манометрии. Для консультации пациентов кроме специалиста-проктолога по показаниям привлекают инфекциониста, хирурга.
Лечение болезни Гиршпрунга
Пациентам с подтвержденным диагнозом рекомендована операция, направленная на восстановление кишечной проходимости за счет удаление денервированного участка. Консервативные методы (коррекция метаболических расстройств, устранение запоров с помощью очистительных, гипертонических и сифонных клизм) применяют на этапе диагностики и предоперационной подготовки. При затягивании консервативной терапии мегаколон прогрессирует, состояние пациента ухудшается, возрастает риск послеоперационных осложнений.
При выборе объема и техники хирургического вмешательства учитывают протяженность аганглиозного сегмента, степень престенотического расширения, возраст больного. В ходе полостной операции производится резекция денервированного участка и патологически измененной расширенной части кишки, создается колоректальный анастомоз. С учетом выбранной техники хирургического лечения патологии Гиршпрунга возможны два подхода к проведению плановых вмешательств:
- Одноэтапная операция. Показана при компенсированной форме болезни и небольшой длине аганглиозного сегмента. Удаляется пораженная кишка и сразу же формируется анастомоз. Преимуществом одноэтапного подхода является меньшая травматичность, однако при неправильной оценке клинической ситуации увеличивается вероятность возникновения осложнений в послеоперационном периоде.
- Двухэтапная операция. Рекомендована пациентам с субкомпенсированным и декомпенсированным вариантами болезни, значительными изменениями толстой кишки выше денервированного участка, протяженным аганглиозным сегментом. На первом этапе после резекции кишечника формируется колостома, которая через некоторое время ушивается с созданием толстокишечного анастомоза в ходе реконструктивного вмешательства.
Экстренно или срочно операция производится при возникновении острой кишечной непроходимости, перфорации кишечника, пролежне стенки кишки каловым камнем. Вмешательство выполняется в объеме резекции сигмовидной кишки, левосторонней гемиколэктомии, колопроктэктомии с наложением колостомы или илеостомы. В дальнейшем пассаж кишечного содержимого восстанавливается хирургическими методами. Диспансерный клинический осмотр прооперированных больных проводится еженедельно в течение месяца после операции, ежеквартально в течение года и ежегодно на протяжении 3-х лет.
Прогноз и профилактика
Исход болезни Гиршпрунга зависит от времени ее выявления и степени поражения нервных ганглиев кишечника. Прогноз относительно благоприятный в случае ранней постановки диагноза и проведения хирургической коррекции. При отсутствии лечения младенческая летальность в первые месяцы жизни достигает 80%. Из-за врожденного характера патологии меры специфической профилактики не разработаны. При появлении первых признаков болезни необходимо немедленно обратиться к врачу, чтобы избежать развития тяжелых осложнений.
Источник
Эта болезнь врожденная. Обычно с ней сталкиваются детские хирурги, но встречается она и у взрослых.
Относится к одним из врожденных заболеваний толстого кишечника, при котором в одном из сегментов кишки отсутствуют нервные ганглиозные клетки. Нейроны, которые обеспечивают сокращение и расслабление кишки. Известна еще как «врожденный мегаколон» или «кишечный аганглиоз».
История
Датский педиатр Харальд Гиршпрунг в 1888 году описал историю болезни двух детей, имеющих сходную клиническую картину: тяжелый запор и вздутие живота. Детям были необходимы ежедневные клизмы. Несмотря на отсутствие какой-либо информации о природе заболевания, была проведена непрерывная терапия, но всё равно оба ребенка умерли. Было проведено посмертное исследование. При вскрытии было обнаружено сужение прямой кишки, а выше суженного отдела было выраженное расширение петель кишечника с изъязвлением слизистой оболочки. Причем не только расширение, но и «стенка также сильно гипертрофирована, особенно мышечный слой». Гиршпрунг не был первым, кто описал это заболевание (до 1888 года было описано 20 случаев), но он был тем, кто предоставил подробное описание этой болезни с учетом своего клинического опыта.
Само название «болезнь Гиршпрунга» стало широко использоваться в лишь в конце 20 века. До 1916 года доктор описал еще 10 случаев заболевания.
Лишь немногие болезни в детской хирургии вызвали столько разногласий и недоразумений, как оптимальное лечение болезни Гиршпрунга.
Почему все происходит
Столкнувшись с чрезвычайным расширением вышележащей толстой кишки хирурги начала 20 века высказывали разные мнения. Одни полагали, что ободочная кишка была заблокирована каким-то механическим препятствием. Были и те, кто считал, что болезнь развивается из-за появления в толстой кишке своеобразных клапанов.
Уже в 1900 году Леннандер практически приблизился к современной точке зрения, когда посчитал болезнь следствием дефицита иннервации кишечника. Он располагал знаниями своего времени о физиологии и видел две возможные причины: снижение действия парасимпатики или усиление действия симпатической нервной системы. В последующем эта теория подтверждалась выявлением у животных в эксперименте расширения толстого кишечника (мегаколона) после пересечения парасимптатических нервов (блуждающего нерва). Клинические наблюдения в 1930-х годах сообщали и расширении толстого кишечника у пациентов, длительно получающих атропин (блокирует холинергические рецепторы парасимпатической системы). Основываясь этим, медики считали болезнь Гиршпрунга вегетативной дисфункцией.
Идей было много. Но совсем непонятно было, что же делать и как помочь пациенту? Врачи продолжали практиковать операции по резекции (удалению) расширенной части кишки. Практически все пациенты, которые подверглись такому лечению не смогли выздороветь и многие умерли (об этом будет известно позже: проблема-то в спазмированной суженной части кишки!). Другие хирурги пытались исправить ситуацию удалением клапанов и складок, сформировнных извитыми расширенными петлями кишечника.
Те же, кто верил в неврогенную природу болезни, пытались улучшить перистальтику толстой кишки. Сам Леннандер наблюдал предприимчивую попытку пропустить электрический ток через клизму у 4-летнего мальчика.
Предполагая нехватку парасимпатической иннервации, в 1940 году было предложено применение фармакологических препаратов-стимуляторов — симпатомиметиков. Пытались зайти и с «другого конца» этой теории. Раз не получается активировать парасимпатику, то замедлим действие симпатической нервной системы (антипода парасимпатики). Практически это достигалось удалением симпатических ганглиев на уровне поясничного отдела позвоночника. Стоит отметить, что небольшой позитивный результат от такого вмешательства все же был, но неудачи были более распространены. Это были 40-е годы. Хотя еще в 1901 году Титтель обратил внимание на отсутствие в пораженной толстой кишке нервных сплетений. Все это путалось другими исследованиями, где нервные клетки в стенке кишки находились (гистология очевидно бралась у пациентов с функциональным запором или при поражении короткого сегмента, когда поражался узкий участок и материал брался не там, где нужно). Да что уж говорить, если даже в 1970 году Эренпрайс утверждал, что нехватка ганглиозных клеток возникает в результате дилатации (расширения) толстой кишки, а не причина этому.
Так что же известно о болезни на настоящее время?
Это врожденное заболевание с наследственной предрасположенностью. В основе лежит ошибка в генах, кодирующих белки, необходимые для нормального развития нервной системы кишечника (энтеральной нервной системы).
Во время нормального внутриутробного развития клетки нервного гребня мигрируют в в стенку кишечника, образуя сложную нервную сеть, состоящую из двух сплетений: между гладкомышечными клетками (стенки Ауэрбаха) и сплетением, расположенным под слизистой оболочкой (сплетение Мейсснера). При болезни Гиршпрунга миграция не является полной и часть толстой кишки остается без нервных клеток. По другой теории считается, что мигрирующие нервные клетки достигают кишечника, но в дальнейшем погибают. Как бы то ни было, в отдельном сегменте толстой кишки не выявляется регулирующих нервных клеток. Причем миграция нейронов происходит от начального отдела кишечника к конечному. Поэтому прямая кишка поражается практически всегда.
Затронутый сегмент не может расслабиться и содержимое кишечника перед этим сужением не может пройти через него. Это приводит к сильному перерастяжению здоровой кишки. Неспособная к сокращению стенка кишечника в дальнейшем фиброзно уплотняется. Всё это приводит к большим проблемам с продвижением кишечного содержимого через этот участок. Кишка, расположенная выше пораженного сегмента, переполняется содержимым и стенка её компенсаторно утолщается.
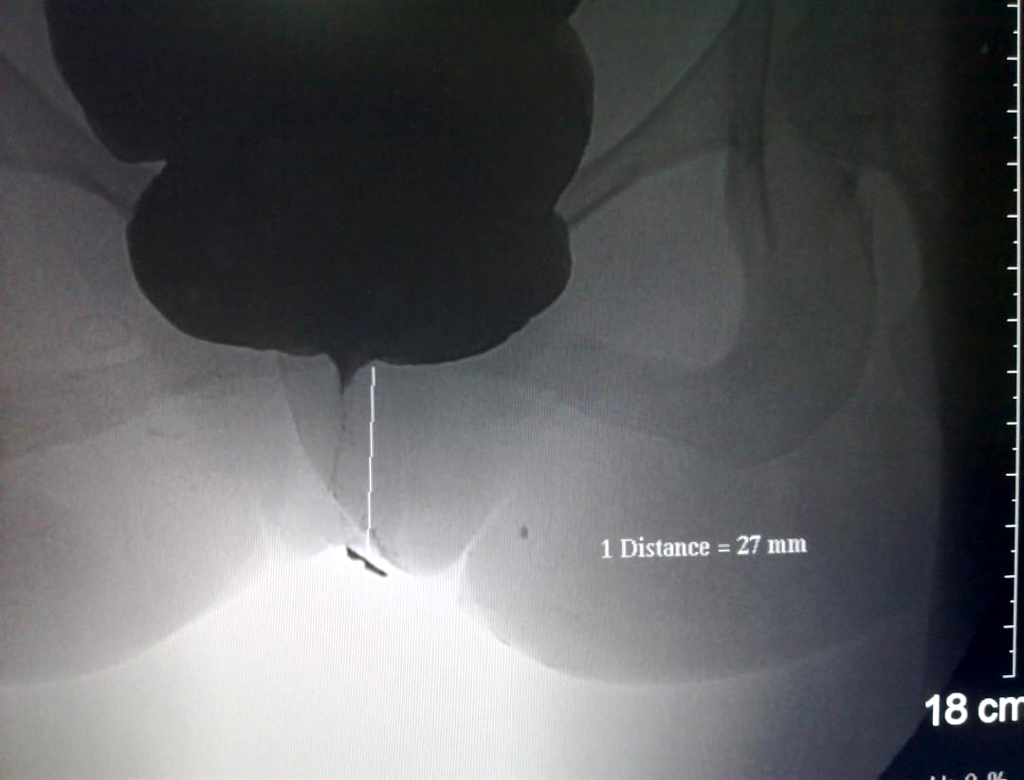
Выраженное сужение дистальной части прямой кишки
Выявлено несколько генов, мутации в которых выявлялись при болезни Гиршпрунга. Но мутация любого из этих генов изолированно не приводит к болезни.
Мутации генов при болезни Гиршпрунга
Ген RET. Расположен в 10 хромосоме. Поломку этого гена считают основной причиной заболевания. Кроме того, мутация гена может приводить к развитию агенезии (отсутствию) почек, феохромоцитоме, множественной эндокринной неоплазии, медуллярному раку щитовидной железы.
Ген GDNF. Открыт в 1993 году. Глиальный нейтрофильный фактор. Ген синтезирует белок, необходимый для дифференцировки и выживания дофаминовых нейронов. Этот пептид имеет уникальную способность специфично восстанавливать дофаминовый нейрон.
Ген NRTN. Открыт в 1998 году. Расположен в 19 хромосоме. Ген синтезирует белок,который регулирует выживание и функцию нейронов. Имеет решающее значение для развития и роста нейронов мозга. Имеются исследования применения белка NRTN для лечения болезни Паркинсона, только проблема в том, что этот белок не проникает через гематоэнцефалический барьер (не попадает в ткань мозга через кровяное русло) и в эксперименте вводится непосредственно в желудочки мозга. Одна лишь мутация этого гена не приводит к болезни Гиршпрунга, однако часто при болезни выявляется сочетание мутации этого гена и мутации в гене RET.
Клиника
Основные симптомы болезни Гиршпрунга — хронический запор и отсутствие самостоятельного стула. Эти симптомы обычно наблюдаются сразу после рождения ребенка. В норме отхождение первого стула (мекония) наблюдается в течение первых двух суток. Поэтому первый, кто может заподозрить заболевание — врач педиатр. По данным Государственного научного центра колопроктологии, диагноз в раннем детстве устанавливается лишь в 19% случаев. Из этих 19% пациентов у двух из трех детей стертое течение заболевания (Ачкасов С.И.,Благодарный Л.А.)
Поэтому стоит помнить об этом заболевании и врачу-колопроктологу, если у него на прием взрослый пациент с жалобами на длительные и упорные запоры. Клиника болезни может быть очень изменчива и не иметь очевидных симптомов. Как уже отмечалось, болезнь Гиршпрунга — это генетические мутации в нескольких генах, каждый из которых в отдельности не вызывает заболевания (по крайней мере такой еще не выявили). Поэтому все же редко, но можно столкнуться с пациентом зрелого возраста, не подозревающем о своем генетическом недуге. Запоры у них носят периодический и нестойкий характер.
При осмотре у большинства пациентов при осмотре можно выявить вздутие живота. Вздутия живота может и не быть, так как толстая кишка длительно находится в компенсированном состоянии. В более тяжелых случаях можно пропальпировать увеличенную, заполненную каловыми массами сигмовидную кишку.
Как ставится диагноз
Очень важное значение в диагностике имеет рентгенологическое исследование толстой кишки с бариевым контрастом. На рентгенограмме отмечается наличие суженной зоны с воронкообразным переходом в вышележащий расширенный отдел. Сложности могут возникнуть при диагностике ректальной формы заболевания, когда поражается лишь небольшой участок (короткосегментная форма).
А вот колоноскопия не дает каких-то дополнительных данных. В основном позволяет оценить состояние слизистой толстой кишки.
Аноректальная манометрия. Этот функциональный метод позволяет выявить нарушение ректоанального тормозного рефлекса. В норме при растяжении каловыми массами (или баллоном манометра при исследовании) происходит снижение тонуса внутреннего сфинктера. При болезни этого не наблюдается.
При подозрении на болезнь Гиршпрунга производится биопсия стенки толстого кишечника. Полученный материал подвергается иммуногистохимическому исследованию. При заболевании выявляется изменение в концентрации нейромедиаторов: повышается количество ацетилхолинэстеразы (медиатора энтеральной нервной системы, стимулирующего сокращение гладкой мускулатуры кишечника) и практически полное отсутствие оксида азота, основного «расслабляющего» медиатора стенки кишечника и кровеносных сосудов (кстати, нитроглицерин, принимаемый под язык при болях в сердце — это прямой источник оксида азота, который расширяет коронарные сосуды).
Классификация
Классификация болезни Гиршпрунга по А.И. Ленюшкину
1. Ректальная 25%
— С поражением проксимального отдела прямой кишки
— С поражением ампулярной и надампулярной частей
2 Ректосигмоидная 70%
— С поражением дистальной части прямой кишки
— С поражением большей части или всей сигмовидной кишки
3. Субтотальная 3%
— С поражением всей левой половины
— С распространением процесса на правую половину толстой кишки
4. Тотальная
— Поражение всей толстой кишки
— С распространением на подвздошную кишку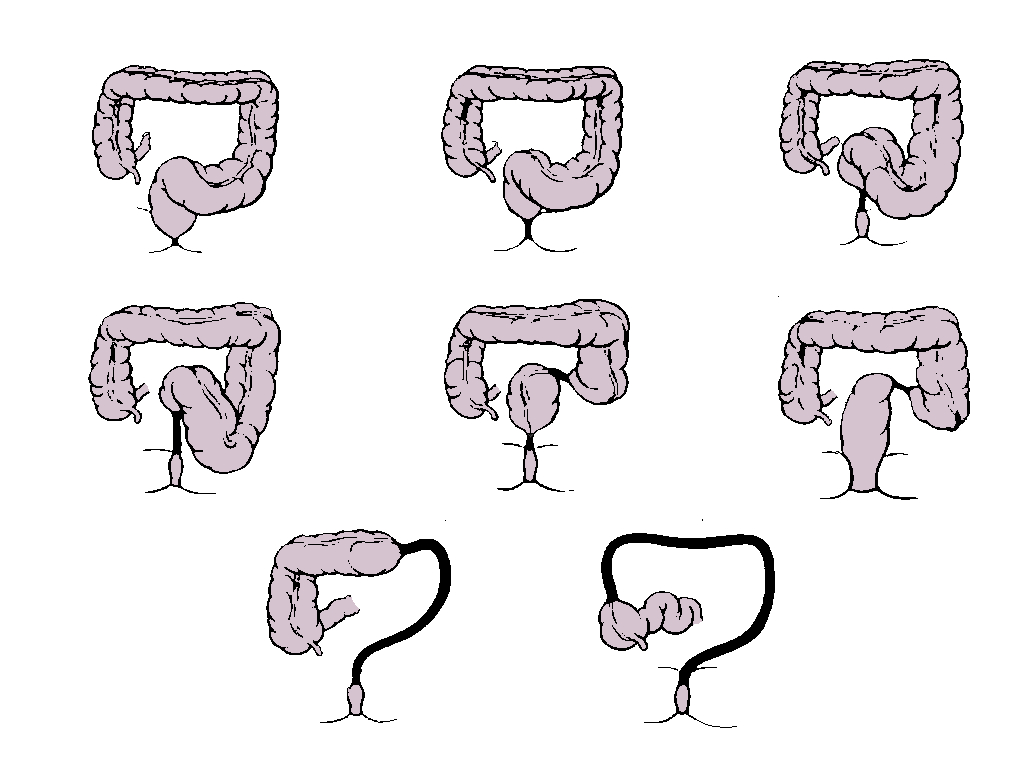
Как лечится
Единственный способ лечения болезни Гиршпрунга — удаление участка кишечника, в котором отсутствуют нервные ганглии. При небольшом пораженном участке возможно одномоментное его удаление с наложением кишечного анастомоза. При декомпенсации хирургическое лечение разделяется на этапы: накладывается колостома, чем разгружается вышележащий отдел кишки, удаляется аганглионарный отдел, а через некоторое время проводится реконструктивная операция. Количество накладываемых стом в настоящее время заметно меньше: в большинстве случаев выполняют одномоментную операцию.
Реконструктивных операций,эффективных и проверенных временем на сегодня три: операция Свенсона, операция Дюамеля и операция Соаве. Из современных — операция Де ла Торре-Мондрагона.
В 1945 году Орвар Свенсон (Orvar Swenson) с помощью прибора для изучения перистальтики изучил сокращения кишечника у больного ребенка, введя аппарат через кишечную стому. Разочаровавшись в радикальных операциях, не приводящих к улучшению, хирурги сороковых годов делали то же, что описывалось за столетия до этого в индийских аюрведах: накладывали колостому, т.е. выводили толстый кишечник на переднюю брюшную стенку. Это приводило к явному улучшению, но болезнь возобновлялась после закрытия стомы. Свенсон принял решение фактически вывести стому, но через анус, через естественное отверстие. В дальнейшем эта манипуляция будет известна как операция Свенсона.
Проведение ректальной биопсии непосредственно на операционном столе — тоже заслуга Свенсона (не смотря на то, что из-за этой процедуры он поругался со своим руководством и был уволен: шеф посчитал её слишком рискованной). Этой манипуляцией определялся уровень кишечника, на котором бы определялись нервные клетки в кишечной стенке. Это в последующем стало обязательной манипуляцией.
Операция Свенсона. Была предложена Орваром Свенсоном (Orvar Swenson) в 1948 году. С нее то и началась хирургия болезни Гиршпрунга. Первым этапом производилось удаление расширенной и измененной части толстого кишечника, затем мобилизовалась прямая и сигмовидная кишка.
R.Hiatt в 1951 году усовершенствовал ее, предложив не удалять пораженную кишку, а выводить ее через прямую кишку с последующей резекцией.
Ю.Ф. Исаков в 1963 году предложил выполнить мобилизацию прямой кишки в передне-заднем направлении косо, чтобы избежать травм семенных пузырьков и семявыносящих протоков. Так что «фирменный» штрих к операции Свенсона добавил Исаков.
В операции два этапа:
— Проводится мобилизация сигмовидной и прямой кишки
— Мобилизованный (подвижный) участок выводится через прямую кишку и накладывается анастомоз.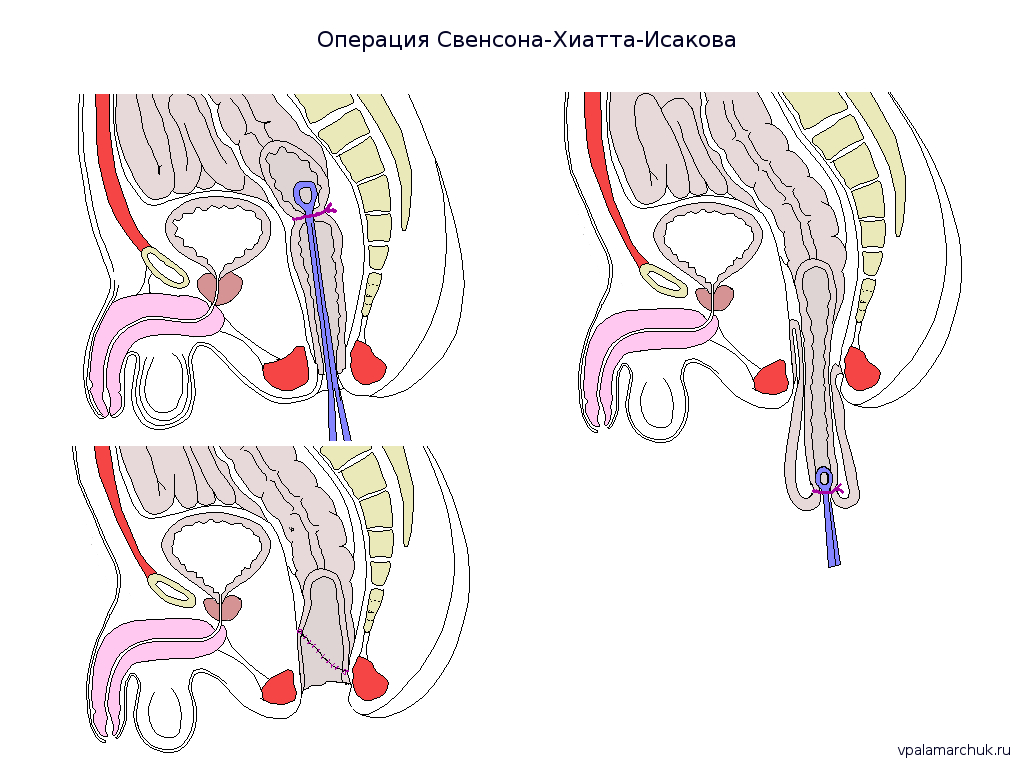
Операция Дюамеля. Описана французским хирургом Бернардом Дюамелем в 1968 году. Была направлена на то, чтобы минимизировать возможные осложнения, возникающие при операции по Свенсону. При этой операции сохранялся пораженный передний отдел прямой кишки. Это позволяло снизить риск повреждения нервов и венозной системы малого таза, а также (что не менее важно), снизить риск повреждения простаты у мальчиков и влагалища у девочек. Суть операции сводилась к следующему: после удаления поражённого участка нормальная ободочная кишка помещается позади культи прямой кишки (между прямой кишкой и крестцом). При этом оставалась нетронутой передняя часть прямой кишки. Формировался анастомоз, нижний край которого был практически на зубчатой линии. Вверху формировалась складка, которая пережималась зажимами. Длительное раздавливание приводило к срастанию стенок и отторжению перегородки. Этот этап операции всегда был довольно сложным, тем более, что нахождение зажимов в прямой кишке в течение нескольких дней переносилась детьми очень тяжело (сейчас накладывают скобки). Операция чаще применяется при тотальных формах болезни Гиршпрунга, т.к. сохраняется всасывающая способность прямой кишки.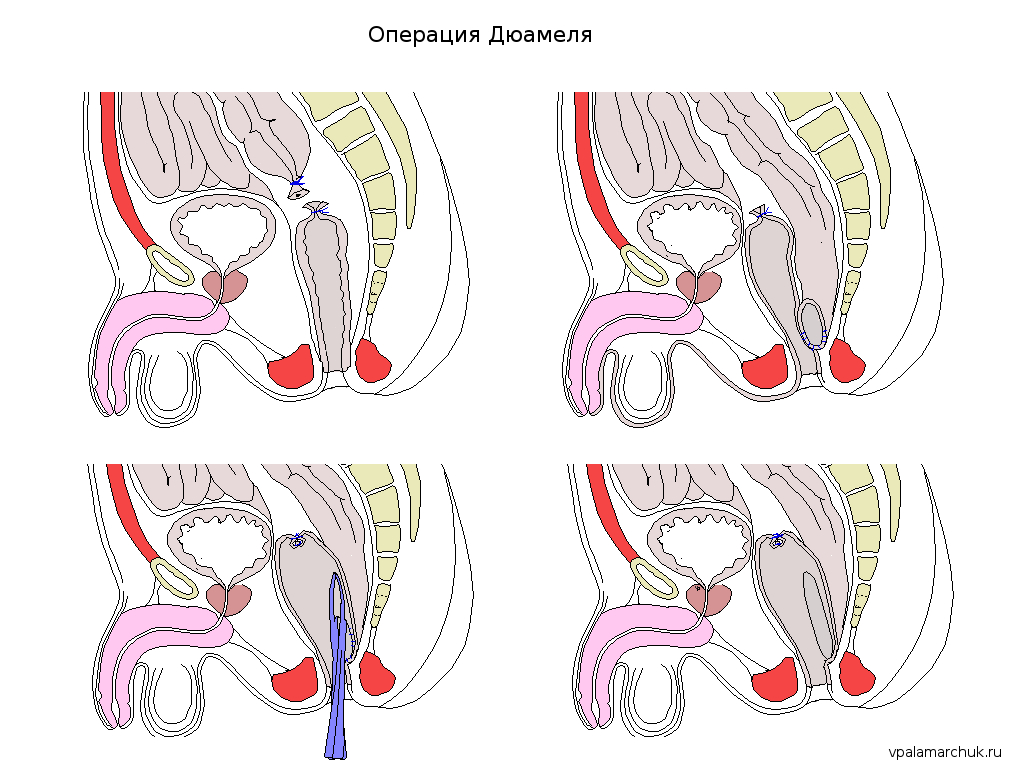
Операция Соаве. Автор описал методику этой операции в 1962 году. Пораженный отдел прямой кишки полностью не удаляется. Проводится отслоение слизистого и фиброзно измененного (и самого прочного) подслизистого слоя. Затем опускается нормальная кишка. Анастомоз формируется самостоятельно.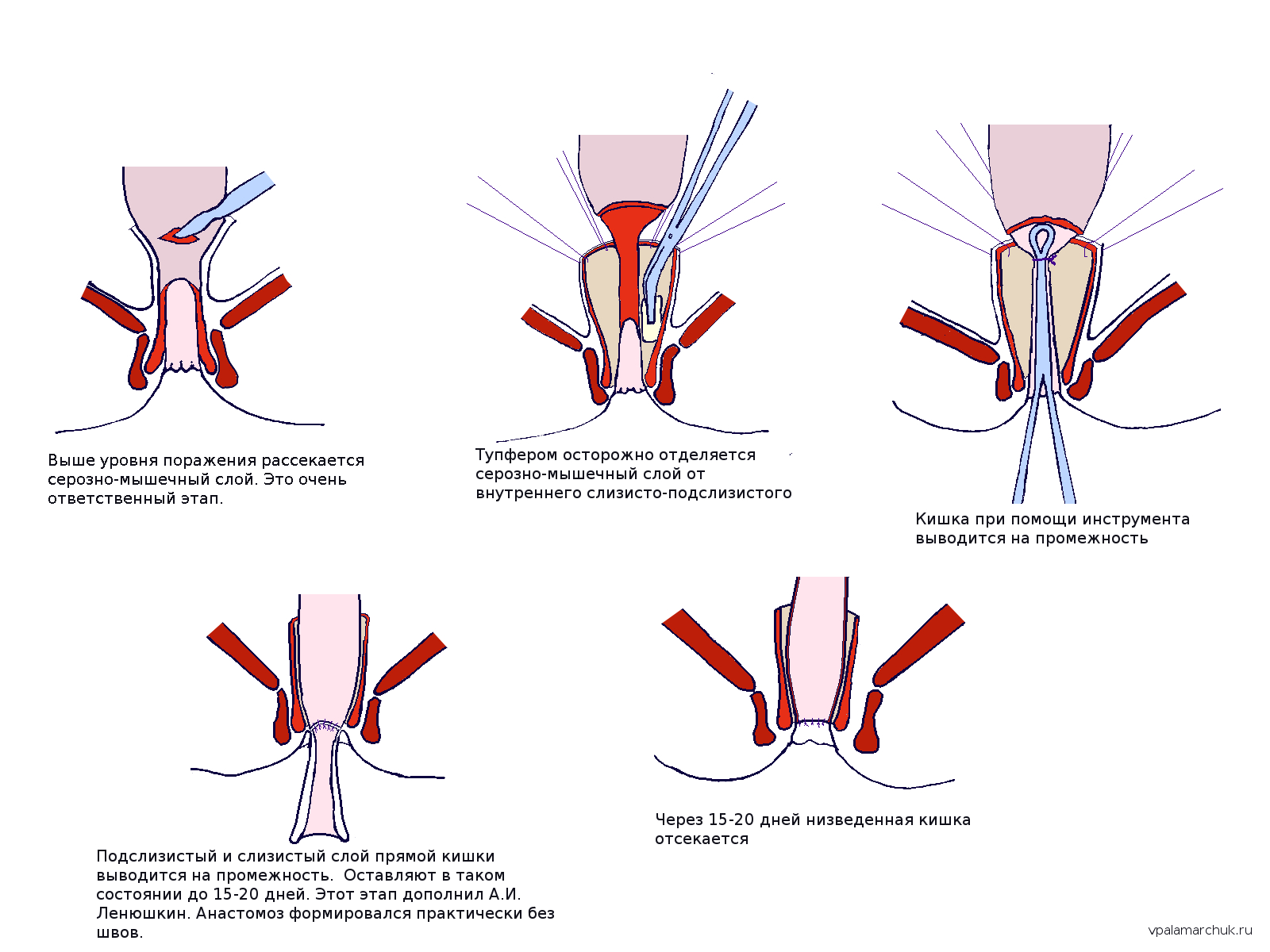
Несомненный плюс — практически полное отсутствие анастомоза. Но технически очень сложна. Эту операцию очень любят детские хирурги.
Операция Де ла Торре-Мондрагона. Была предложена в 1998 году. Авторами была описана методика низведения толстой кишки через прямую кишку, избегая разрез на передней брюшной стенке. Проводится разрез до мышечного слоя несколько выше зубчатой линии. Через сформированный мышечный рукав производится низведение пораженной части прямой и сигмовидной кишки.
Если вы нашли опечатку в тексте, пожалуйста, сообщите мне об этом. Выделите фрагмент текста и нажмите Ctrl+Enter.
Источник
