Интервенционные методы лечения ишемической болезни сердца бокерия
Стельмашок Виталий Иванович, заведующий лабораторией неотложной и интервенционной кардиологии РНПЦ «Кардиология», кандидат медицинских наук
В настоящее время сердечно-сосудистые заболевания являются основными причинами смертности населения в развитых странах мира. К сожалению, Республика Беларусь здесь не является исключением: так, согласно данным статистической отчетности, в нашей стране сердечно-сосудистая патология является абсолютным лидером по вкладу в показатель общей смертности — более половины от общего числа летальных исходов случаются по причине болезней системы кровообращения.
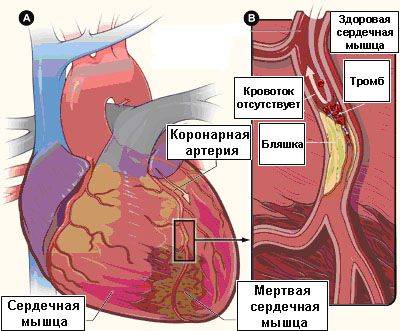
Ишемическая болезнь сердца относится к числу наиболее значимых сердечно-сосудистых заболеваний — на долю ее различных форм приходится приблизительно 2/3 смертей от общего числа летальных исходов по причине сердечно-сосудистых заболеваний. Суть ишемической болезни сердца состоит в том, что в коронарных артериях, кровоснабжающих сердечную мышцу, вследствие прогрессирования атеросклероза происходит рост и развитие атеросклеротических бляшек. При наличии стабильных бляшек происходит постепенный их рост, приводящий к сужению просвета артерии (см. рис. 1), к нарушению кровотока по данной артерии и к кислородному голоданию (ишемии) находящихся в зоне кровоснабжения данной артерии органов и тканей. Клинически это проявляется наличием стабильной стенокардии различной степени тяжести.
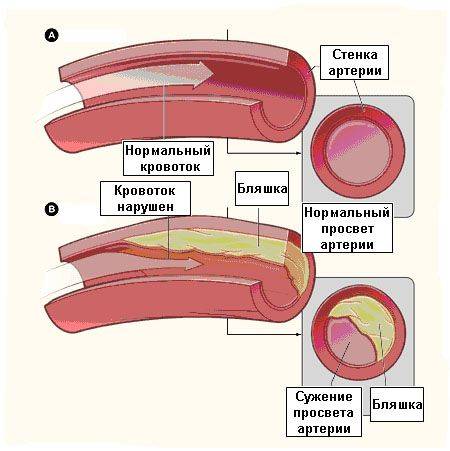
Рис. 1. Непораженная коронарная артерия (а), стабильная атеросклеротическая бляшка (б), вызывающая сужение просвета сосуда
В свою очередь, нестабильные атеросклеротические бляшки являются «ранимыми», склонными к разрыву, что ведет к появлению тромба на поверхности разорвавшейся атеросклеротической бляшки (см. рис. 2), к острому нарушению кровотока по данной артерии, что клинически проявляется развитием нестабильной стенокардии или же инфаркта миокарда.
Несмотря на значительные успехи медикаментозной терапии, применяемой для лечения пациентов, страдающих ишемической болезнью сердца, данный вид лечения не всегда способен в полной мере решить поставленные задачи, которые заключаются в улучшении качества (то есть уменьшение тяжести и числа эпизодов стенокардии) и в увеличении продолжительности жизни пациентов. В данных случаях на помощь медикаментозной терапии приходят интервенционные и хирургические методы лечения данного заболевания.

Рис. 2. Сердце (а), разорвавшаяся нестабильная атеросклеротическая бляшка с тромбом на ее поверхности (б),
приводящие к прекращение кровотока за зоной бляшки и к развитию омертвения части сердечной мышцы
В том случае, когда планируется хирургическое или интервенционное вмешательство у больного, страдающего ишемической болезнью сердца, необходимо проведение специального инвазивного исследования, называемого коронарографией. Данная процедура нужна для того, чтобы точно оценить характер поражения коронарных артерий, что позволит выбрать наиболее оптимальную тактику дальнейшего лечения — выполнение малоинвазивных вмешательств, таких как чрескожная баллонная ангиопластика/стентирование коронарных артерий или же «большой» операции — аортокоронарного шунтирования. Следует отметить, что проведение коронарографии особенно необходимо пациентам с ишемической болезнью сердца, у которых имел место перенесенный инфаркт, или же стенокардия плохо поддается медикаментозному лечению.
Процедура коронарографии выполняется под местной анестезией, после которой проводится пункция крупной магистральной артерии на ноге или же на руке. Затем в пунктированную артерию устанавливается специальная трубка — интрадьюсер, через которую в аорту, а затем в устье коронарных артерий проводятся специальные катетеры. Через данные катетеры в артерии сердца вводят специальное рентгеноконтрастное вещество, которое током крови разносится по коронарным сосудам, и делает их видимыми для специальной установки — ангиографа, который показывает весь результат на экране монитора. Поэтому, где, как и насколько поражены сосуды сердца, видно очень хорошо. Особо следует отметить, что во время процедуры пациент не чувствует никаких болевых ощущений (в сосудах нет болевых рецепторов), находится в сознании и может наблюдать за картиной его собственных коронарных артерий, выводимых на монитор ангиографического аппарата. Процедуры коронарографии, а также других диагностических и лечебных миниинвазивных вмешательств на сосудах выполняются специальными врачами — рентгенэндоваскулярными хирургами.
Бояться коронарографии не стоит — это важная диагностическая процедура. В некоторых случаях, крайне редко, возможны осложнения (нарушение ритма сердца, аллергия на контрастное вещество, тромбоз артерии и т.д.), но они всегда поддаются экстренной помощи.
Ангиопластика и стентирование коронарных артерий — самые щадящие методы хирургического лечения суженных сосудов. Данная процедура, как и коронарография, является безболезненной и проводится под местной анестезией (пациент находится в сознании). В настоящее время ежегодно во всем мире выполняется более 2 млн. подобных процедур.
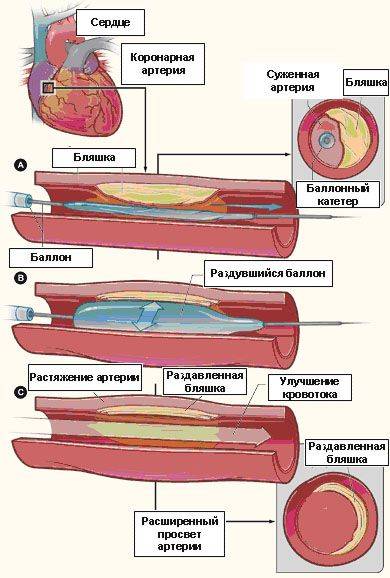
Рис. 3. Нерасправленный баллонные катетер позиционирован в зоне сужения коронарной артерии (а), раздутие баллона,
приводящее к фрагментации бляшки (б), полное восстановление проходимости коронарной артерии (с)
Начинается процедура ангиопластики/стентирования коронарных артерий с проведения под рентгеновским контролем и установке в устье коронарной артерии особого инструмента — направляющего катетера. После того, как направляющий катетер установлен в устье коронарной артерии, по нему в сосуд проводится тонкий проводник диаметром около 0,35 мм, таким образом, что его кончик находится за зоной сужения. Затем в сосуд по проводнику вводится специальный баллонный катетер, который позиционируется в зоне сужения сосуда. После этого врач раздувает баллон (обычно до 10-14 атмосфер) в течение 20-30 сек, и просвет сосуда расширяется, после чего баллонный катетер сдувается и извлекается из просвета сосуда (см. рис. 3).
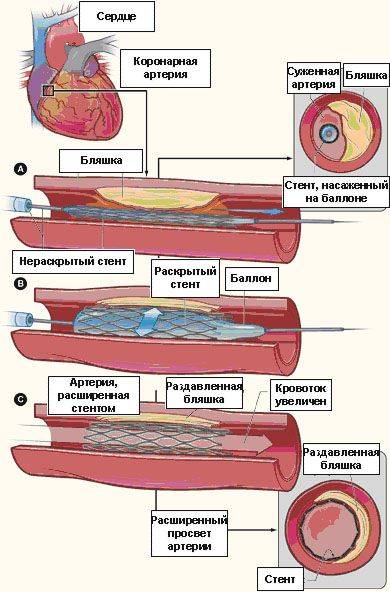
Рис. 4. Насаженный на баллоне стент позиционирован в зоне сужения коронарной артерии (а),
раздутие баллона с имплантацией стента (б), полное восстановление проходимости коронарной артерии (с)
С целью предупреждения развития повторного сужения леченного сосуда (рестеноза) рентгенэндоваскулярный хирург практически всегда после удаления баллонного катетера устанавливает в расширенное место сосуда стент — проволочную конструкцию цилиндрической формы, служащую каркасом для данного участка артерии. Коронарный стент насажен на баллон, который находится в нераскрытом состоянии, и в таком виде по проводнику проводится к пораженному месту артерии. После того, как врач четко выполнит позиционирование стента в нужном участке сосуда, производится раздутие баллона, на котором насажен стент (обычно до 12-20 атмосфер), в процессе которого стент расширяется и плотно прижимается к сосудистой стенке (см. рис. 4). Затем врач сдувает баллон и удаляет его из сосуда, а раскрывшийся стент остается в просвете сосуда пожизненно. Заканчивается процедура ангиопластики/стентирования коронарных артерий удалением проводника, катетера и интрадьюсера из сосудистого русла. Место прокола сосуда прижимается для остановки кровотечения либо закрывается при помощи специальных устройств. В среднем длительность процедуры ангиопластики/стентирования коронарных артерий занимает от 45 минут до 3 часов.
Однако даже стентирование не дает стопроцентной гарантии исключения рестеноза. Дело в том, что со временем стент обрастает соединительной тканью и вновь происходить сужение просвета артерии. Поэтому в тех случаях, когда у пациента ожидаемо высокий риск развития рестеноза, имплантируются специальные стенты с лекарственным покрытием, выделяющие антипролиферативные препараты, которые подавляют рост соединительнотканных компонентов.
Следует также помнить о том, что после процедуры ангиопластики/стентирования коронарных артерий пациент должен постоянно принимать специальную терапию. Во-первых, это касается антитромбоцитарных препаратов, способствующих разжижению крови: аспирин — постоянно и клопидогрель в течение 1-12 месяцев. В случае имплантации стентов с покрытием, выделяющими антипролиферативные препараты, длительность приема клопидогреля увеличивается до 12-24 месяцев. Помимо вышеуказанного, необходимо пожизненно принимать статины (препараты, снижающие уровень холестерина) — это является надежным методом профилактики роста атеросклеротических бляшек в других участках коронарных артерий. Также необходимо принимать медикаментозную терапию, предназначенную для лечения ишемической болезни сердца и, при необходимости, лекарства, снижающие артериальное давление. Регулярный и правильный прием медикаментозной терапии под контролем врача-кардиолога — залог успеха на будущее.
Однако не следует полагать, что проведение процедуры ангиопластики/стентирования возможно только в пораженных атеросклерозом артериях сердца. В настоящее время разработаны и успешно применяются специальные баллонные катетеры и стенты для лечения пораженных атеросклерозом сонных артерий, почечных артерий, висцеральных артерий и артерий нижних конечностей; специальные протезы (стент-графты) используются для лечения аневризм аорты. Широко в клинической практике применяются различного типа окклюдеры, которые нужны для устранения врожденных дефектов межпредсердной и межжелудочковой перегородок сердца; разрабатываются специальные клапаны, которые в будущем можно будет имплантировать миниинвазивно, без остановки сердца, что позволит избежать выполнения «большой» операции у некоторых пациентов, страдающих пороками сердца. Уже сейчас с большой долей вероятности можно утверждать, что в последующие годы показания к применению интервенционных методов для лечения сердечно-сосудистых заболеваний будут только расширяться, а данные процедуры проводиться все чаще и чаще.
На сегодняшний день в Республике Беларусь головным учреждением, где происходит разработка и внедрение новых интервенционных методов в клиническую практику для лечения больных с сердечно-сосудистой патологией, является Республиканский научно-практический центр «Кардиология». Высококвалифицированный персонал работающих в центре врачей рентгенэндоваскулярных хирургов выполняет сложные и высокотехнологичные миниинвазивные диагностические и лечебные процедуры на сердце и сосудах на высоком профессиональном уровне с хорошими ближайшими и отдаленными результатами.
Источник
Ключевые слова: ишемическая болезнь сердца, инфаркт миокарда, аортокоронарное шунтирование, чрескожная транслюминальная коронарная ангиопластика, коронарное стентирование, чрескожное коронарное вмешательство, рестеноз, стент с лекарственным покрытием
Несмотря на бесспорные успехи консервативной терапии [3,15,17,18,23,24,30 и др.], эффект лечения ИБС, по мнению большинства исследователей, во многих случаях оказывается недостаточным [8,16,26,29 и др].
В связи с этим за последние 45 лет широкое распространение получила хирургическая ревас-куляризация миокарда. Так, в 1964г. В.И. Колесов впервые наложил маммарно-коронарный анастомоз (МКА), а в 1967г. Р. Фавалоро впервые выполнил операцию аортокоронарного шунтирования (АКШ) [22].
Основное преимущество АКШ – продолжительное сохранение результата вмешательства. К 5-летнему сроку остаются проходимыми 80,3% венозных и 95,7% артериальных шунтов, к 10-летнему сроку – 67% и 90,3% соответственно [49]. Другим существенным достоинством АКШ является возможность проведения эффективной реваскуляризации независимо от морфологии артериального поражения [28]. В то же время недостатками АКШ являются появление в трансплантате атеросклеротических и фиброзных изменений, развитие вазоспазма и тромбоза шунта [55,60], а также необходимость выполнения торакотомии в ходе вмешательства и потребность в наличии специального дорогостоящего оборудования [7,11].
Кровотечения и периоперационный инфаркт миокарда (ИМ) при МКА и АКШ могут развиваться у 5-10% больных [26]. В рекомендациях Американской ассоциации сердца и Американского кардиологического колледжа приводятся данные, согласно которым смертность при КШ составляет 1-2%, а частота периоперационного ИМ – до 10% [59]. Госпитальная летальность после КШ достигает 4,6% при нестабильной стенокардии и 11,8% при ИМ [27].
Таким образом, несмотря на ряд неоспоримых преимуществ, хирургические методы не позволяют полностью решить проблему лечения ИБС, что послужило толчком для развития менее травматичных и более дешевых интервенционных методов лечения.
Впервые чрескожную транслюминальную коронарную ангиопластику (ЧТКА) как метод лечения стенозов коронарных артерий у больных ИБС предложил А. Gruntzig [50]. Суть данного метода заключается в подведении к стенозированному участку нераскрытого баллона c последующим его раздуванием, в результате чего происходит механическое растяжение сосудистой стенки [11].
Несмотря на значительное симптоматическое улучшение, после проведения ЧТКА в течение первых 6 мес. после эндоваскулярного вмешательства у 25-30% больных в связи с развитием рестеноза может возникнуть необходимость в выполнении повторных процедур реваскуляризации миокарда (ЧТКА или АКШ). При этом госпитальная смертность составляет 0,5-1,5%, в 0,2-0,3% случаев больные нуждаются в проведении экстренного АКШ, у 1-3% отмечается инфаркт миокарда [20,35].
Наиболее грозным осложнением является острая окклюзия леченого сосуда (3-8% случаев), причинами которой являются тромбоз, диссекция сосудистой стенки и ангиоспазм. В незначительном проценте случаев развиваются перфорация коронарного сосуда, острая сердечная тампонада [11].
По данным исследования BENESTENT 1 [29], оптимальный результат ЧТКА – достижение резидуального стеноза менее 30%. Через 12 мес. частота рестеноза у больных с оптимальным результатом ЧТКА составляет 16%, в группе стентирования – 22%, выживаемость отмечается в 77% случаев.
Основоположниками стентирования были J. Puel и U. Sigwart, которые в 1986г. произвели чрескожную имплантацию металлического стента в коронарную артерию человека [цит. по 21].
Создание внутрисосудистого эндопротеза (стента) открыло совершенно новую эру лечения ИБС. К 2004г. стентирование составляло более 90% эндоваскулярных вмешательств при ИБС [20,37] и, в настоящее время, под термином коронарная ангиопластика (с англ. percutaneous coronary intervention –чрескожное коронарное вмешательство – ЧКВ) подразумевают именно стентирование [5,14].
Анализируя данные различных широкомасштабных рандомизированных исследований (STRESS, BENESTENT, ARTS, RAVEL, FIM) и наблюдений отдельных авторов, можно сделать вывод о высокой частоте успеха (90-96%) и низкой частоте осложнений при стентировании нескольких коронарных сосудов одномоментно. Однако такая методика сопряжена с более высокой частотой рестенозирования в отдаленном периоде – 18-36% и зависит от количества стентированных стенозов [25].
Так, F.Versaсi et al. [63] продемонстрировали преимущество стентирования перед ЧТКА: частота рестеноза после стентирования составляла 19%, а после ЧТКА – 40% (р<0,02). Показатель выживаемости через год после вмешательства также был выше у пациентов после эндопротезирования (87% в сравнении с 70%).
Сравнение коронарного стентирования и ЧТКА в лечении первичных стенозов коронарных артерий в рандомизированном исследовании START, включавшем 452 пациента, 35% из которых имели двух- и трехсосудистое поражение, также показало превосходство стентирования [43].
Непосредственные и отдаленные результаты стентирования, как и результаты ЧТКА, находятся в прямой зависимости от количества стентированных стенозов, их локализации, морфологии сужения, диаметра артерии. Тем не менее, по мнению M. Degertekin et al., они превосходят результаты ЧТКА [37].
Стенты улучшают кратковременный и долгосрочный прогноз после ЧТКА. Однако лечение множественных поражений при помощи стентирования было довольно ограничено из-за высокого риска тромбоза и рестеноза в области имплантации [7,29]. В дальнейшем, по мере совершенствования техники раскрытия стентов, результаты стентирования значительно улучшились [1,4,11,14,25,39,51,62,67].
Дальнейшее широкое распространение ЧKB наряду с преимуществами выявило также ограничения и недостатки данного метода, среди которых основным оказался рестеноз [33,40,45]. В конце 90-х годов появились стенты с лекарственным покрытием (СЛП) из препаратов с антипролиферативной или цитостатической активностью, которые в несколько раз уменьшили вероятность рестеноза [6,11,12,25]. Широкое внедрение в клиническую практику в начале XXI века СЛП открыло новые перспективы в лечении больных с ИБС и, особенно, в сочетании с сопутствующими заболеваниями системного характера (диабет, ожирение и др.) [9,13,38,65].
В многочисленных рандомизированных и обсервационных исследованиях показаны неоспоримые преимущества применения СЛП при лечении ИБС. Так, удалось значительно снизить частоту рестеноза при распространенных множественных поражениях коронарных арте-рий [2,8,9,19,31,34,42,46,48,49,53,57,58,61,64,66].
Однако в большом количестве исследований, свидетельствующих о высокой эффективности СЛП, в последнее время появились сообщения о случаях тромбоза и иных осложнений после их имплантации в отдаленные сроки наблюдения [47]. Подобные сообщения требуют внимания и тщательного анализа, поскольку эффективность лечения не может конкурировать с его безопасностью [5].
Спектр лекарственных препаратов, применяемых для покрытия стентов, весьма обширен, но наиболее часто используются противоопухолевые химиопрепараты [35,42,49]. Самое изученное из них – сиролимус, или рапамицин. Применение стентов Cypher с рапамицином на настоящий день является золотым стандартом и его клиническая эффективность продемонстрирована во многих рандомизированных исследованиях [31,39,41,48,52,53,62,67].
Так, например, Л.А. Бокерия и соавт. [10] обобщили результаты лечения 1700 больных ИБС, которым за период с 1998г. по 2006г. в НЦССХ им. А.Н. Бакулева РАМН была выполнена имплантация непокрытых стентов и стентов Cypher. Применение СЛП, несмотря на увеличение объема и комплексности выполняемых вмешательств, позволяет добиться значительного снижения частоты рестенозирования в отдаленном периоде наблюдения.
A.A. Bavry et al. [32] в мета-анализе, проведенном на основании результатов 6 рандомизиро-ванных исследований (2963 пациента) показали, что по сравнению с непокрытыми металлическими стентами sirolimus-покрытые стенты не увеличивают риск развития тромбоза спустя 13,5 месяцев после коронарной ангиопластики.
M.C. Morice et al. [56] обобщили результаты мультицентрового рандомизированного исследования, проведенного в 2003-2004гг. в девяноста больниц Европы, Латинской Америки и Азии. В исследовании было выявлено, что по сравнению с непокрытыми металлическими стентами применение sirolimus- и paclitaxel-покрытых стентов заметно улучшило ангиографические послеоперационные исходы после коронарной ангиопластики. Однако существенных различий в частоте развития рестеноза после применения этих двух типов стентов выявлено не было.
В то же время появились сообщения, указывающие на то, что использование СЛП ассоциируется с увеличением некоронарной смертности и увеличением частоты инфарктов миокарда в отдаленном периоде из-за поздних тромбозов стентов [36,44,51].
Так, Д.А. Асадов [5] делает вывод о том, что, несмотря на низкий базовый риск рестеноза, СЛП не дают статистически значимых преимуществ в отношении кардиальных осложнений, но увеличивают риск некардиальных, а также летальных исходов, связанный с длительным приемом антиагрегантных препаратов.
Последующие мета-анализы частично опровергли эти предположения, однако изучение долговременной клинической эффективности и безопасности СЛП остается актуальным по сегодняшний день [32,38,54,65].
Таким образом, наличие противоречивых данных о безопасности и эффективности стентиро-вания обусловливает дальнейшее изучение ближайших и отдаленных результатов ЧКВ при лечении больных ИБС с использованием стентов как с лекарственным покрытием, так и простых металлических стентов.
Литература
- Նազարյան Ա. Նորք-Մարաշ Բժշկական Կենտրոնում սրտի պսակաձև անոթների ստենտավորման արդյունքները միջամտությունից մեկ տարի անց:I հայ-Ֆրանսիական սրտաբանական գիտաժողովի նյութեր:Երևան,2007, էջ. 47-49.
- Սարգսյան Վ.Դեղորայքապատ ստենտով ստենտավորված հիվանդների կլինիկական արդյունքները ՆՄԲԿ-ում 2006 թ-ի ընթացքում 1-ին հայ-Ֆրանսիական սրտաբանական գիտաժողովի նյութեր.Երևան,2007, էջ.29-31.
- Адамян К.Г., Наргизян А.Б., Тумасян Л.Р. Ингибиторы ангиотензинпревращающего фермента при инфаркте миокарда и вторичной профилактике ишемической болезни сердца Мед. наука Армении НАН РА, 2008, т. 48, 1, с. 3-25.
- Алекян Б.Г., Подзолков В.П., Бузиашвили Ю.И. и соавт. Эндоваскулярная хирургия забо-леваний сердца и сосудов в XXI веке. Вестник РАМН, 2003, 12, с. 6-15.
- Асадов Д.А. Международный опыт и результаты собственных исследований по применению стентов с противопролиферативными свойствами и стентов без покрытия. Дис. … канд. мед. наук: 14.00.44 / ГУ Научный центр сердечно-сосудистой хирургии РАМН. М., 2009.
- Бабунашвили A.M., Юдин И.Е., Дундуа Д.П. и соавт. Стенты с лекарственным покрытием при лечении диффузных атеросклеротических поражений коронарных артерий. Актуальные вопросы болезней сердца и сосудов. 2007, 4, с. 57-63.
- Беленков Ю.Н., Савченко А.П., Данилов Н.М. и соавт. Первый опыт применения сиролимус-покрытых стентов Cypher в лечении ишемической болезни сердца. Кардиология. 2004, 3, с. 9-14.
- Билич А.Г. Клиническая эффективность и безопасность стентов с лекарственным покрытием при коронарной ангиопластике у пациентов с ишемической болезнью сердца с различными рентгенморфологическими типами поражения: Дис. … канд. мед. наук: 14.00.19. ГУ РНЦХ РАМН. М., 2009.
- Бокерия Л.А. Результаты эндоваскулярного лечения с использованием стентов с антипроли-феративным покрытием у больных ишемической болезнью сердца с ожирением. Грудная и сердечно-сосудистая хирургия, 2008, 2, с. 14-18.
- Бокерия Л.А., Алекян Б.Г., Голухова Е.З. и соавт. Применение стентов с лекарственным антипролиферативным покрытием в лечении больных ишемической болезнью сердца. Креа-тивная кардиология. 2007, 1, с. 193-198.
- Бокерия Л.А., Алекян Б.Г., Коломбо А., Бузиашвили Ю.И. Интервенционные методы лечения ишемической болезни сердца. М.: НЦССХ им. А.Н.Бакулева РАМН, 2002, 417 с.
- Бокерия Л.А., Алекян Б.Г., Стаферов А.В. Стенты с антипролиферативным лекарственным покрытием. М.: Геотар-Медицина, 2008. с. 232-260 (Руководство по рентгенэндоваскулярной хирургии сердца и сосудов, в 3-х томах. под ред. Л.И. Бокерия; т. 3).
- Бокерия Л.А., Бузиашвили Ю.И., Алекян Б.Г. и соавт. Эффективность и ближайшие послеопе-рационные результаты стентирования коронарных артерий у больных ИБС и сахарным диабетом. Бюл. НЦССХ им. А.Н.Бакулева РАМН. 2006, т.7, 5, 58-65.
- Бокерия Л.А., Ступаков И.Н., Гудкова Р.Г., Самородская И.В. Сердечно-сосудистая хирур-гия в России: методы оценки результатов и перспектив развития. Грудная и сердечно-сосудистая хирургия. 2002, 3, с. 4-11.
- Ватутин Н.Т., Михальченко Е.В. Ишемическая болезнь сердца. Унiверситетська клiнiка. – 2008, 2, с. 43-51.
- Ганюков В.И., Протопопов А.В. Чрескожные эндоваскулярные вмешательства при остром коронарном синдроме. Новосибирск: ИЦП Юпитер, 2005, 155 с.
- Глезер М.Г., Семенцов Д.П., Соболев К.Э. Лечение пациентов с острым инфарктом миокарда в условиях типичной клинической практики. Кардиология, 2005, т.45, 1, с. 9-13.
- Голиков А.П. Сравнительная оценка эффективности тромболитической терапии тканевым активатором плазминогена и стрептокиназой у больных инфарктом миокарда. Кардиология, 2001, 3, с. 10-12.
- Жамгырчиев Ш.Т. Клиническое значение коронарных стентов с лекарственным покрытием. Тер. Архив, 2007, т. 79, 9, с. 79-84.
- Захарова О.В., Араблинский А.В., Иоселиани Д.Г. Эндоваскулярные методы лечения больных ИБС с рестенозом после первичной баллонной ангиопластики. Клиническая медицина, 2004, 10, с. 22-26.
- Козлов К.Л. Интервенционная пластика венечных артерий. СПб.: Элби, 2000.
- Колесов В.И. Хирургия венечных артерий. Москва: Медицина, 1977.
- Манак Н.А. Современные взгляды на профилактику ишемической болезни сердца. Мед., 2003,5. с 5-9.
- Павлова Т.В. Диагностика, прогнозирование и коррекция нарушений системы гемостаза у пациентов с ишемической болезнью сердца. Дис. … д-ра мед. наук: 14.00.06. Государственный Самарский медицинский университет МЗ РФ. М., 2008.
- Постоялко А.С. Сравнительный анализ эффективности использования стентов с лекарствен-ным покрытием и без него у больных ишемической болезнью сердца при одно- и многососудистом стенозировании коронарных артерий: Дис. … канд. мед. наук: 14.00.06. Российский кардиологический научно-производственный комплекс. М., 2005.
- Пырьев А.Н. Роль нарушений системы гемостаза в патогенезе, прогнозе и диагностике тромбогеморрагических осложнений консервативного и хирургического лечения ишемической болезни: Дис. … д-ра мед. наук: 14.00.06. Государственный институт усо-вершенствования врачей Минобороны РФ. М., 2008.
- Савченко А.П., Акчурин Р.С., Ширяев А.А. и соавт. Результаты коронарного стентирования и хирургического лечения у больных ИБС с многососудистым поражением коронарного русла. Кардиология. 2002, 5, с. 42-47.
- Савченко А.П., Матчин Ю.Г., Смирнов М.А., Лякишев А.А. Количественная и качественная оценка рентгеноморфологии рестеноза коронарной артерии после баллонной ангиопластики и стентирования. Вестн. Рентгенологии и радиологии. 1999, 4, с. 4-13.
- Самко А.Н., Буза В.В., Карпов Ю.А. Место коронарного стентирования в лечении ишемичес-кой болезни сердца. Русский медицинский журнал. 2002, т. 10, 19, с. 4-6.
- Тер-Григорян В.Р., Айрапетян Г.Г., Мурадян Ф.О. Сравнительная эффективность различных антиангинальных препаратов при лечении постинфарктной безболевой ишемии миокарда. Научные труды III конгресса кардиологов Армении. Институт кардиологии МЗ РА, Ассоциация кардиологов Армении. Ереван, 2001, с. 51-55.
- Bavry A.A., Kumbhani D.J., Helton T.J., Bhatt D.L. Risk of thrombosis with the use of sirolimus-eluting stents for percutaneous coronary intervention (from registry and clinical trial data). Am. J. Cardiol., 2005, vol. 95, 12, p. 1469-72.
- Bavry A.A., Kumbhani D.J., Helton T.J., Bhatt D.L. What is the risk of stent thrombosis associated with the use of paclitaxel-eluting stents for percutaneous coronary intervention? A meta-analysis. J. Am. Coll. Cardiol., 2005, 45, p. 941-6.
- Chan A.W., Moliterno D.J. Restenosis: the clinical issues. In: Topol E.J. Textbook of interventional cardiology, 4th ed. Philadelphia: W.B. Saunders, 2003, р. 415-454.
- Colombo A., Drzewiecki J., Banning A. et al. Randomized study to assess the effectiveness of slow- and moderate-release polymer-based paclitaxeleluting stents for coronary artery lesions. Circulation, 2003, vol. 108, p. 36-42.
- Colombo A., Moses J.W., Morice M.C. et al. Randomized Study to Evaluate Sirolimus-Eluting Stents Implanted at Coronary Bifurcation Lesions. Circulation, 2004, vol. 109, p. 1244-1249.
- Colombo A, Stankovic G, Orlic D, et al. The modified T stenting technique with crushing for bifurcation Lesions: immediate results and 30-day outcome. Cathet. Cardiovasc. Interv., 2003, Vol. 60, 145-151.
- Degertekin M., Serruys P.W., Foley D.P. et al. Persistent inhibition of neointimal hyperplasia after sirolimus-eluting stent implantation: Longterm (up to 2 years) clinical, angiographic, and intravascular ultrasound follow-up. Circulation, 2002, vol. 106, p. 1610-3.
- Dibra A., Kastrati A., Mehilli J. et al. Paclitaxel-eluting or sirolimus-eluting stents to prevent restenosis in diabetic patients. N. Engl. J. Med., 2005, 353, р. 663-670.
- Farb A., Burke A.P., Kolodgie F.D. Pathological mechanisms of fatal late coronary stent thrombosis in humans. Circulation, 2003, 108, р. 1701-1706.
- Hayashi S., Watanabe N., Nakazawa K. et al. Roles of P-selectin in inflammation, neointimal formation, and vascular remodeling in balloon-injured rat carotid arteries. Circulation, 2000, vol.102, 14, р. 1710-1717.
- Haraguchi G., Pruitt S., Brodeur A. et al. Increased expression of eNOS by Endeavor zotarolimus-eluting stents compared to other DES in porcine coronary artery implants. Am. J. Cardiol., 2006. 98 (Suppl). р. 32-33.
- Herdeg C. Oderhojf M., Baiunbach A. et al. Local Paclitaxeldelivery for the prevention of restenosis: biological effects and efflcacy in vivo. Ibid, 2000, vol. 35, 7, p. 1996-1976.
- Hwang C.W., Wu D., Edelman E.R. Physiological Transport Forces Govern Drug Distribution for Stent-Based Delivery. Circulation, 2001, vol.104, 5, р. 600-605.
- Gogo P.-Jr., Schneider D., Watkins M. et al. Systemic inflammation after drug-eluting stent placement. J. Thromb. Thrombolysis, 2005, vol. 19, 2, р. 87-92.
- Goldberg S.L, Loussararian A., De Gregorio J. et al. Predictors of diffuse and aggressive intrastent restenosis J. Am. Coll. Cardiol., 2001, 37, p. 1019-1025.
- Goy J., Stauffer J., Siegenthaier M. et al. A prospective randomized comparison between paclitaxel and sirolimus stents in the real world interventional cardiology: the ISAR-Diabetes trial J. Am. Coll. Cardiol., 2005, vol. 45, 2, p. 308-311.
- Grube E. Drug eluting stents: a new era in the stent technology. Cardiol. Int., 2001, 2, p. 5-6.
- Grube E., Hauptmann K., Buellesfeld L. et al. Six-month results of a randomized study to evaluate safety and efficacy of a biolimus A9 eluting stent with a biodegradable polymer coating. Euro Intervention, 2005, 1, р. 53-57.
- Grube E., Silber S.M., Hauptmann К.E. et al. Taxus I: prospective, randomized, double-blind comparison of NIRx™ stents coated with paclitaxel in a polymer carrier in de-novo coronary lesions compared with uncoated controls. Circulation, 2001, vol. 104, 17, suppl. 11. abstr. 2197.
- Gruentzig A. Transluminal dilatation of coronary-artery stenosis. The Lancet, 1978, vol. 311, Issue 8058. р. 263-264.
- Guyton R.A. Coronary artery bypass is superior to drug-eluting stents in multivessel coronary artery disease. Ann. Thorac. Surg., 2006, 81, р. 1949-1957.
- Joner M., Finn A.V., Farb A. et al. Pathology of drag-eluting stents in humans: delayed healing and late thrombotic risk. J. Am. Coll. Cardiol., 2006, 48, р. 193-202.
- Kandzari D. TCT-368: the TAXUS Cypher What’s Your Real World Experience (TC-WYRE) Study: A multicenter comparison of DES in over 2500 patients.Transcatheter Cardiovascular Therapeutics (TCT). Washington, DC; 2006.
- Kastrati A., Dibra A., Eberle S. et al. Sirolimus-eluting stents vs paclitaxel-eluting stents in patients with coronary artery disease: meta-analysis of randomized trials. JAMA, 2005, 294, р. 819-825.
- Lemos P.A., Serruys P.W., van Domburg R.T. et al. Unrestricted Utilization of Sirolimus-Eluting Stents Compared With Conventional Bare Stent Implantation in the Real World: The Rapamycin-Eluting Stent Evaluated At Rotterdam Cardiology Hospital (RESEARCH) Registry. Circulation, 2004, vol.109, p. 190-195.
- Morice M.C., Colombo A., Meier B. et al. Sirolimus – vs paclitaxel-eluting stents in de novo coronary artery lesions: the REALITY trial: a randomized controlled trial. JAMA, 2006, 295, р. 895-904.
- Park D.W., Park S.W., Park K.H. et al. Frequency of and risk factors for stent thrombosis after drug-eluting stent implantation during long-term follow-up. Am. J. Cardiol., 2006, 98, p. 352-356.
- Patit C.V., Nikolsky E., Boulos E. et al. Muitivessel coronary artery disease: current revascularization strategies. Eur. Heart J., 2001, 22, р. 1183-1197.
- Report of the American College of Cardiology. American Heart Association Task Force on Practice Guidelines. Circulation, 2001, 103, р. 3019-3041.
- Serruys P.W., Foley D.P., Suttorp M.J. et al. A randomized comparison of the value of additional stenting after optimal balloon angioplasty for long coronary lesions: Final results of the additional value of nir stents for treatment of long coronary lesions (ADVANCE) study. J. Am. Coll. Cardiol., 2002, Vol. 39, p. 393-399.
- Steffel J., Latini R.A., Akhmedov A. et al. Rapamycin, but not FK-506, increases endothelial tissue factor expression: implications for drug-eluting stent design Circulation., 2005, 112, р. 2002-2011.
- Stettler C., Allemann S., Egger M. et al. Efficacy of drug eluting stents in patients with and without diabetes mellitus: indirect comparison of controlled trials Heart., 2006, 92, р. 650-657.
- Versaci F., Gaspardone A., Tomai F. et al. A comparison of coronaryartery stenting with angioplasty for isolated stenosis of proximal left anterior descending coronary artery. N. Engl. J. Med.,1997, vol. 336, р. 817-822.
- Virmani R., Farb A., Guagliumi G., Kolodgie F.D. Drug-eluting stents: caution arid concerns for long-term outcome. Coron Artery Dis. 2004, vol. 15, p. 313-318.
- West N.E., Ruygrok P.N., Disco C.M. et al. Clinical and angiographic predictors of restenosis after stent deployment in diabetic patients. Circulation. 2004, vol. 109, р. 867-873.
- Windecker S. CYPHER vs TAXUS: an independent patient-based meta analysis including the currently completed randomized controlled trials.Transcatheter Cardiovascular Therapeutics Symposium; October 17-21, 2005, Washington. DC.
- Yeh E., Khan B. The potential role of antiplatelet agents in modulating inflammatory markers in atherothrombosis. J. Thromb. Haemost., 2006, vol. 4, 1, р. 2308-2316.
Источник
