К наследственным болезням соединительной ткани относятся
Наследственные болезни соединительной ткани (дисплазии соединительной ткани, ДСТ) — группа нозологических форм, которые объединяет вовлечение в патогенез ферментных систем и структурных белков соединительной ткани, прежде всего касающихся синтеза и обмена коллагена. Для этих заболеваний характерна высокая частота в педиатрической практике, полиорганность поражения, выраженный клинический полиморфизм, сложность диагностики и лечения.
Все наследственные или врожденные болезни соединительной ткани принято делить на дифференцированные дисплазии соединительной ткани, имеющие определенный тип наследования и очерченную манифестную клиническую симптоматику (синдромы Марфана, Элерса—Данлоса, Альпорта, несовершенный остеогенез, разновидности хондродисплазии) и недифференцированные дисплазии соединительной ткани (НДСТ), включающие множество вариантов без четко очерченной симптоматики.
Термин «дисплазия» означает нарушение формирования органов и тканей в эмбриональном и постнатальном периодах. Так как соединительная ткань составляет около 50% массы тела, ДСТ чаще имеет распространенный характер, реже — локальный с преимущественным поражением каких-либо органов и систем.
При наследственных заболеваниях соединительной ткани, вызванных дефектом разных генов, отмечается сходная клиническая симптоматика, появляются структурные изменения, обусловленные потерями гликозаминогликанов и оксипролина, в результате содержание гиалуроновой кислоты в соединительной ткани снижается, она теряет прочность и эластичность. Фенотипические и органные проявления зависят от того, какая ткань поражена больше — плотная или рыхлая. Поражение плотной оформленной соединительной ткани манифестирует особенностями строения скелета и включает астенические телосложение, долихостеномелию, арахнодактилию, деформацию грудной клетки и позвоночника, плоскостопие.
Для вариантов с преимущественным поражением рыхлой ткани характерны изменения со стороны кожи (истончение, гиперэластичность), уменьшение мышечной массы, патология органов зрения, нервной, сердечно-сосудистой и дыхательной систем, почек, нарушение репарации тканей.
Синдром Марфана (Marfan) (СМ) — наследственное заболевание, характеризующееся системным поражением соединительной ткани. Тип наследования — аутосомно-доминантный с высокой пенетрантностью и различной экспрессивностью. Частота диагностированных случаев 1:10-15 тыс, тяжелых форм 1:25-50 тысяч родившихся. Мальчики и девочки поражаются с одинаковой частотой.
Этиология и патогенез. В 95% случаев СМ вызывается мутациями в гене белка фибриллина (15q21.1) — гликопротеида, участвующего в микрофибриллярной системе, обеспечивающей основу эластическим волокнам соединительной ткани. В 5% встречаются мутации в генах, кодирующих синтез а 2-цепей коллагена (7q22.1), вызывающие развитие заболевания с относительно легкой клинической картиной. У всех больных в биоптате кожи и культуре фибробласгов выявляется снижение числа микрофибрилл.
Клиническая картина СМ подразделяют на два вида: астенический (преимущественно детский) и неастенический. Больных отличает высокий рост, долихоцефалия, удлиненное лицо, длинные тонкие конечности (долихостеномелия), арахнодактилия, дефицит массы тела, гипоплазия мышц и подкожной клетчатки, неловкость движений. Кожа гиперэластична, суставы гипермобильны, часто встречаются высокое аркообразное небо, деформации грудной клетки (воронкообразная, килевидная) и аномалии позвоночника (сколиоз в 60%, кифоз, ювенильный остеохондроз, гипермобильность в шейном отделе), плоскостопие, систолический шум. Длина 3-го пальца кисти 10 см и более (скрининг-тест на СМ у старших детей); соотношение размаха рук к длине тела > 1,03.
Характерны раннее начало и постепенное формирование клинической картины. У новорожденных отмечаются только арахнодактилия и долихостеномелия. Патология органа зрения (миопия высокой степени, подвывих хрусталика — у 3/ 4 больных, сферичность или уменьшение размеров хрусталика, отслойка сетчатки) и астеническое телосложение становятся заметными в 1-3 года, деформации грудной клетки формируются в 4-7 лет, сердечно-сосудистая патология в 2-7 лет и позже. Изменения скелета максимальны к 14-16 годам. Характерны поражения крупных сосудов и сердца (до 90% больных), чаще всего обнаруживают пролапс митрального клапана (ПМК), расширение аорты вплоть до ее аневризмы. Нередко имеются бедренные или паховые грыжи, варикозное расширение вен, привычные вывихи, кровоточивость, нефроптоз, эмфизема легких, спонтанный пневмоторакс. Интеллект снижен у 20-25%, в 50% случаев имеются нарушения эмоционально-волевой сферы. Вместе с тем среди больных — А. Линкольн, Н. Паганини, X. К. Андерсен, Ш. де Голль, К. И. Чуковский — люди, отличавшиеся высоким интеллектом и нестандартным мышлением.
Синдром Элерса—Данлоса (Ehlers—Danlos) (СЭД) — генетически гетерогенное заболевание, обусловленное разнообразными мутациями в генах коллагена, либо в генах, отвечающих за синтез ферментов, принимающих участие в созревании молекул коллагена. Характеризуется гиперэластичностью кожи, подкожными сферулами, переразгибанием суставов, легкой ранимостью тканей и геморрагическим синдромом. Истинная распространенность неизвестна вследствие сложности верификации и большого числа легких форм, частота диагностированных случаев 1:5000 родившихся, тяжелые формы встречаются редко (1:100 000).
Этиология и патогенез СЭД — группа заболеваний соединительной ткани, различающихся по типу наследования, клиническим особенностям и биохимическому дефекту. В большинстве случаев наследуется по аутосомно-доминантному типу, сопровождается уменьшением количества или изменением структуры коллагена. Описано 11 типов заболевания с разными типами наследования, клиническими особенностями и биохимическими дефектами, самыми распространенными из них являются I, II и III.
Клиническая картина Гиперэластичность, бархатистость кожи («резиновая» кожа), характерные рубцы по типу «папиросной бумаги», подкожные узелки, гипермобильность суставов, мышечная гипотония, слабость связочного аппарата, грыжи, аномалии развития сердца и сосудов, кровоточивость, наличие патологии глаз (миопия, астигматизм, отслойка сетчатки), склонность к выпадению зубов. В большинстве случаев СЭД проявляется с рождения, выраженность расстройств нарастает в пре- и пубертатный период.
Несовершенный остеогенез (несовершенное костеобразование, osteogenesis imperfecta, болезнь Лобштейна—Вролика) — наследственное заболевание, проявляющееся повышенной ломкостью костей, вызванное мутациями в генах коллагена I типа, обусловленное нарушением функции остеобластов, что приводит к нарушению эндостального и периостального окостенения. Частота у новорожденных 7,2:10 ООО, наиболее распространен 4 тип.
Этиология и патогенез Одно из наиболее частых моногенных заболеваний соединительной ткани, вызванное мутациями в генах, кодирующих синтез р,- и Р2-цепей коллагена I типа. Гены картированы соответственно на 17q21.31-q22.05 и 7q22.1. Клинический полиморфизм обусловлен характером мутаций: инсерции, делеции, сплайсинговые и нонсенс-мутации. Всего описано свыше 160 мутаций. Наиболее тяжелые формы наблюдаются в случаях замены глицина на другую аминокислоту, мутации гена коллагена а 2 протекают благоприятнее, чем а г Нередки спорадические случаи. Снижена дифференцировка остеобластов, нарушено отложение солей кальция и фосфора, недостаточна продукция и заторможена резорбция костного вещества.
Клиническая картина Типичный признак — склонность к переломам длинных трубчатых костей, ребер и ключиц при минимальной травме; чем раньше возникают проявления, тем тяжелее протекает заболевание. Другие аномалии: укорочение и искривление конечностей вследствие переломов, мышечные атрофии, разболтанность или контрактуры суставов, голубые склеры, желто-коричневый цвет зубов, деформации позвоночника и грудной клетки, длительное незаращение родничков и швов черепа, преобладание за счет этого мозгового черепа над лицевым, отосклероз. Переломы хорошо срастаются с образованием костной мозоли. Нехарактерны переломы костей черепа. Дети часто обездвижены, отстают в соматическом развитии.
Источник
Наследственные болезни соединительной ткани относятся к наиболее распространенным генетическим синдромам. К ним относят чаще всего несовершенный остеогенез, синдромы Элерса—Данло и Марфана.
Классификация этих синдромов основывается обычно на результатах работы McKusick, который проанализировал признаки, симптомы и морфологические изменения у большого числа больных. Однако классификация осложняется гетерогенностью этих синдромов. У больных, членов некоторых семей, отсутствует, например, один или несколько кардинальных признаков. В других семьях выявляют больных с двумя или тремя разными синдромами. Гетерогенность может быть обнаружена и среди членов одной семьи. Например, у одних больных в семье определяется дислокация суставов, характерная для синдрома Элерса—Данло, у других — хрупкость костей, типичная для несовершенного остеогенеза, а у третьих с тем же генным дефектом симптомы вообще отсутствуют. Из-за этих трудностей классификация, основанная на клинических данных, в конце концов, должна будет смениться классификацией, основанной на результатах анализа молекулярных дефектов в отдельных генах.
Организация и химический состав соединительной ткани. Соединительная ткань (или ткани) имеет довольно расплывчатое определение: внеклеточные компоненты, служащие опорой и связывающие воедино клетки, органы и ткани. К соединительным тканям относятся в основном кости, кожа, сухожилия, связки и хрящи. Они включают в себя такие кровеносные сосуды и синовиальные пространства и жидкости. На самом деле, соединительная ткань входит в состав всех органов и тканей в виде мембран и перегородок.
Соединительные ткани содержат большие количества жидкости в виде фильтрата крови, в котором находится почти половина всего альбумина организма. Большинство соединительных тканей заполнены или окружены фибриллами или волокнами коллагена (табл. 319-1) и содержат протеогликаны.
Различия соединительных тканей до некоторой степени обусловлены незначительной вариабельностью размеров и ориентации коллагеновых фибрилл. В сухожилиях они собраны в толстые параллельные пучки, в коже расположены менее упорядочение. В костях фибриллы строго организуются вокруг гаверсовых каналов, ригидность этой архитектуре придает гидроксиапатит. Основной коллаген сухожилий, кожи и костей (коллаген I типа) состоит из двух полипептидных цепей, продуктов разных структурных генов. Различия между перечисленными тканями в большой мере связаны с разной экспрессией структурных генов коллагена I типа, т. е. с разными количеством синтезируемого коллагена, толщиной и длиной образующихся фибрилл и их расположением.
Некоторые различия между соединительными тканями обусловлены присутствием ткане- или органоспецифических генных продуктов. Кости содержат белки, играющие важнейшую роль в минерализации коллагена, аорта — эластин и сопутствующий микрофибриллярный белок, несколько типов коллагена и другие компоненты. Базальная мембрана, лежащая под всеми эпителиальными и эндотелиальными клетками, содержит коллаген IV типа и другие тканеспецифические макромолекулы, а кожа и некоторые другие соединительные ткани—небольшие количества особых видов коллагена.
Таблица 319-1. Состав соединительной ткани в разных органах
| Орган | Известные компоненты | Примерное количество, % сухой массы | Свойства |
| Кожа (дерма), связки, сухожилия | Коллаген I типа | Пучки волокон с высоким пределом прочности при растяжении | |
| Коллаген III типа | 5—15 | Тонкие фибриллы | |
| Коллаген IV типа, ламинин, энтактин, нидоген | Менее 5 | В базальной мембране под эпителием и в кровеносных сосудах | |
| Коллаген V—VII типов | Менее 5 | Распределение и функции неясны | |
| Фибронектин | Менее 5 | Связан с коллагеновыми волокнами и клеточной поверхностью | |
| Протеогликаны’ | 0,5 | Обеспечивают упругость | |
| Гиалуронат | 0,5 | Обеспечивает упругость | |
| Кость (демине-рализован-ная) | Коллаген’1 типа | Сложная организация фибрилл | |
| Коллаген V типа | 1—2 | Функция неясна | |
| Протеогликаны | » » | ||
| Сиалопротеины | » » | ||
| Остеонектин | 2—3 | Роль в оссификации | |
| Остеокальцин | Возможная роль в оссификации | ||
| а 2-Гликопроте ин | То же | ||
| Аорта | Коллаген I типа | 20—40 | |
| Коллаген III типа | 20—40 | Тонкие фибриллы | |
| Эластин, микрофибриллярный белок | 20—40 | Аморфное вещество, эластические фибриллы | |
| Коллаген IV типа, лами | Менее 5 | В базальной мембране | |
| нин, энтактин, нидоген | | | |
| Коллаген V и VI типов | Менее 2 | Функция неясна | |
| Протеогликаны | Менее 3 | Мукополисахариды, в основном хондроитинсульфат и дерматан-сульфат; гепарансульфат в базальной мембране | |
| Хрящ | Коллаген II типа | 40—50 | Тонкие фибриллы |
| Коллаген IX и Х типов | 5—25 | Возможная роль в созревании | |
| Протеогликаны | 15—20 | Обеспечивают упругость | |
| Гиалуронат | 0,5—2 | Обеспечивает упругость |
‘ Протеогликановые структуры изучены недостаточно. Установлено примерно пять белковых ядер, и к каждому присоединен один вид мукополисахаридов или несколько. К основным мукополисахаридам кожи и сухожилий относятся дерматансульфат и хондроитин-4-сульфат, аорты — хондроитин-4-сульфат и дерматан-сульфат, хряща — хондроитин-4-сульфат, хондроитин-6-сульфат и кератансульфат. Базальная мембрана содержит гепарансульфат.
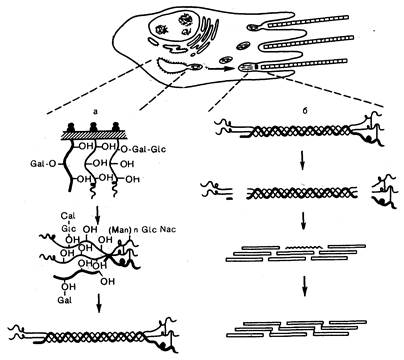
Биосинтез соединительной ткани. Синтез соединительных тканей заключается в самосборке из молекулярных субъединиц с точными размерами, формой и поверхностными свойствами. Молекула коллагена представляет собой длинный тонкий стержень, состоящий из трех а-полипептидных цепей, скрученных в жесткую, похожую на канат структуру (рис. 319-1). Каждая -цепь состоит из простых повторяющихся аминокислотных последовательностей, в которых каждый третий остаток представлен глицином (Гли). Поскольку каждая -цепь содержит около 1000 аминокислотных остатков, ее аминокислотную последовательность можно обозначить как (-Гли-Х-У-)ззз, где Х и Y — любые аминокислоты, кроме глицина. Тот факт, что каждый третий остаток — это глицин (самая малая аминокислота), весьма важен, так как он должен входить в стерически ограниченное пространство, в котором сходятся все три нити тройной спирали. Две -цепи в коллагене I типа одинаковы и называются 1(1). Третья же имеет несколько другую аминокислотную последовательность и называется 2(1). Некоторые типы коллагена состоят из трех одинаковых -цепей. Те участки -цепей, в которых на месте Х находится пролин или на месте Y — гидроксипролин, придают жесткость всей молекуле коллагена и удерживают ее в форме тройной спирали. Гидрофобные и заряженные аминокислоты в положениях Х и Y имеют вид кластеров на поверхности молекулы и определяют способ, которым одна молекула коллагена спонтанно связывается с другими, образуя цилиндрические фигуры, характерные для каждой коллагеновой фибриллы (см. рис. 319-1).

Рис.319-1. Схематическое изображение синтеза фибриллы коллагена I типа в фибробласте.
Внутриклеточные этапы сборки молекулы проколлагена (а): гидроксилирование и гликозилирование про-а-цепей начинается вскоре после того, как их N-концы проникнут в цистерны шероховатой эндоплазматической сети, и продолжается после сближения С-пропептидов трех цепей и образования между ними дисульфидных связей. Расщепление проколлагена с образованием коллагена, самосборка коллагеновых молекул в свободно прилегающие друг к другу нити и перекрестное связывание их в фибриллы (б): отщепление пропептидов может происходить в криптах фибробласта или в некотором отдалении от клетки (воспроизведено с разрешения из Prockop and Kivinkko).
Если структура и функция молекулы коллагена достаточно просты, то ее синтез весьма сложен (см. рис. 319-1). Белок синтезируется в виде предшественника, называемого проколлагеном, масса которого примерно в 1,5 раза больше массы молекулы коллагена. Эта разница обусловлена присутствием в проколлагене дополнительных аминокислотных последовательностей как на N-, так и на С-конце. Для образования нитей коллагена необходимо действие специфической N-протеиназы, отщепляющей N-концевые пропептиды, и специфической С-протеиназы, отщепляющей С-концевые пропептиды. По мере сборки про--цепей коллагена на рибосомах эти цепи проникают в цистерны шероховатой эндоплазматической сети. Гидрофобные «сигнальные пептиды» на N-концах отщепляются, и начинается ряд дополнительных посттрансляционных реакций. Остатки пролина в позиции Y под действием специфической гидроксилазы, требующей аскорбиновой кислоты, превращаются в оксипролин. Другая гидроксилаза в присутствии аскорбиновой кислоты точно так же гидроксилирует остатки лизина в позиции Y. Необходимость аскорбиновой кислоты для действия обеих гидроксилаз, вероятно, объясняет, почему при цинге не заживают раны (см. гл. 76). Многие гидроксилизиновые остатки подвергаются дальнейшей модификации, гликолизируясь галактозой или галактозой и глюкозой. К С-концевым пропептидам каждой цепи присоединяется крупный, богатый маннозой олигосахарид. С-концевые пропептиды сближаются, и между ними образуются дисульфидные связи. Когда в каждой про--цепй окажется примерно 100 гидропролиновых остатков, белок спонтанно сворачивается, приобретая конформацию тройной спирали. Свернувшись, белок под действием N- и С-протеиназ превращается в коллаген.
Фибриллы, образованные путем самосборки коллагеновой молекулы, обладают высоким пределом прочности при растяжении, и эта прочность еще более увеличивается за счет перекрестных реакций с образованием ковалентных связей между -цепями соседних молекул. Первый этап перекрестного связывания — окисление ферментом лизиноксидазой аминогрупп в остатках лизина и гидроксилизина с образованием альдегидов; последние затем и формируют прочные ковалентные связи друг с другом.
Коллагеновые фибриллы и волокна во всех тканях, кроме костной, стабильны на протяжении почти всей жизни и распадаются только при голодании или истощении тканей. Однако фибробласты, синовиальные и другие клетки способны продуцировать коллагеназы, расщепляющие коллагеновую молекулу в точке, отстоящей от N-конца примерно на 3/4 длины молекулы, и тем самым запускают дальнейшее разрушение коллагеновых фибрилл и волокон другими протеиназами. В костях же непрерывно происходят разрушение и ресинтез коллагеновых фибрилл, что служит необходимым условием перестройки кости. Таким образом, для сборки и сохранения коллагеновых фибрилл в тканях требуется координированная экспрессия ряда генов, продукты которых необходимы для посттрансляционного формирования этих фибрилл или участвуют в метаболизме коллагена.
Сборка фибрилл коллагена I типа аналогична сборке фибрилл коллагена II типа в хряще и коллагена III типа в аорте и коже. При формировании же нефибриллярных коллагенов, таких как тип IV в базальных мембранах, не происходит отщепления глобулярных доменов на концах молекул. Сохраняясь, эти домены участвуют в самосборке мономеров в плотные сети. Волокна эластина компонуются тем же путем. Однако эластиновый мономер представляет собой одну полипептидную цепь без четкой трехмерной структуры, самообразующую аморфные эластические волокна.
Синтез протеогликанов сходен с синтезом коллагена в том отношении, что он начинается со сборки полипептидной цепи, называемой белковым ядром. В цистернах шероховатой эндоплазматической сети белковое ядро модифицируется путем присоединения остатков Сахаров и сульфата, которые образуют крупные мукополисахаридные боковые цепи. После секреции во внеклеточное пространство белковое ядро с его мукополисахаридными боковыми цепями связывается с соединяющим белком, а затем с длинноцепочечной гиалуроновой кислотой, образуя зрелый протеогликан с относительной молекулярной массой в несколько миллионов.
Построение кости следует тем же самым принципам, что и сборка других соединительных тканей (см. также гл. 335). Первый этап заключается в отложении остеоидной ткани, которая состоит в основном из коллагена I типа (см. рис. 319-1). Далее, «еще не до конца выясненным путем происходит минерализация остеоидной ткани; особые белки, такие как остеонектин, связываются со специфическими участками коллагеновых фибрилл и затем хелируют кальций, начиная минерализацию.
Значение для наследственных болезней. Наше знание химии и биохимии соединительных тканей недостаточно полно, но тем не менее позволяет понять некоторые клинические особенности наследственных болезней этих тканей. Например, понятно, почему многие из этих болезней имеют системные проявления. Поскольку весь коллаген I типа синтезируется на одних и тех же двух структурных генах, любая мутация этих генов должна экспрессироваться во всех тканях, содержащих коллаген I типа. Тканевая или органная специфичность болезни может быть объяснена двояко. Один из механизмов может заключаться в том, что болезнь вызывается мутацией гена, экспрессирующегося только в одной или двух соединительных тканях. Например, у больных с синдромом Элерса — Данло IV типа имеются мутации генов проколлагена III типа, и его проявления ограничены изменениями кожи, аорты и кишечника, т. е. тканей, богатых коллагеном III типа. Вторая причина тканевой специфичности болезней более тонка. Разные участки молекул коллагена выполняют разные биологические функции. Так, если речь идет о коллагене I типа, то отщепление N-концевых пропептидов необходимо для сборки крупных коллагеновых фибрилл и волокон в связках и сухожилиях. При неполном отщеплении N-пропептидов белок образует тонкие фибриллы. Следовательно, больные с такими мутациями генов проколлагена I типа, препятствующих эффективному отщеплению N-пропептидов, должны страдать преимущественно дислокацией бедренных и других крупных суставов. У них редко бывают переломы, поскольку формирование толстых фибрилл коллагена I типа, по-видимому, менее важно для нормальной функции костей, чем для нормальной функции суставных связок. Наоборот, у больных с мутациями, затрагивающими структуру других участков молекулы проколлагена I типа, может преобладать костная патология.
Современные данные о химии матрикса позволяют понять причины гетерогенности симптоматики и у больных с одинаковыми генными дефектами. Экспрессия гена коллагена или протеогликана зависит от координированной экспрессии генов ферментов, принимающих участие в посттрансляционной модификации этих соединений, а также от экспрессии генов других компонентов того же матрикса. В связи с этим конечное влияние этой мутации на функциональные свойства такой сложной структуры, как кость или крупный кровеносный сосуд, зависит от различий в «генетическом фоне» разных лиц, а именно от различий в экспрессии .большого семейства других генов, продукты которых влияют на ту же структуру. Клинические проявления болезни должны зависеть и от других факторов, влияющих на соединительную ткань, таких как физическая нагрузка, травмы, питание и гормональные аномалии. Следовательно, имеется широкая основа для вариабельности клинических проявлений у больных с одним и тем же дефектом.
Выявление молекулярных дефектов. Для того чтобы выявить молекулярный дефект у больного с наследственной болезнью соединительной ткани, требуются большие усилия (рис. 319-2). Одна из причин этого заключается в том, что у двух не состоящих в родственной связи больных, даже с идентичными клиническими симптомами, молекулярные дефекты различны. Вторая причина сводится к тому, что белки и протеогликаны соединительной ткани представляют собой крупные молекулы, которые трудно перевести в раствор и получить в чистом виде. Кроме того, у больных дефект определяет синтез аномального, быстро распадающегося белка. В связи с этим при анализе тканей трудно установить, какой именно генный продукт аномален. Третья причина — большие размеры генов компонентов матрикса. В случае проколлагена I типа ген про-al (1)-цепи состоит из 18 000 пар оснований, а ген про-а2(1)-цепи— из 38000 пар. Каждый из этих генов имеет примерно 50 экзонов, большинство которых сходны по структуре. С помощью доступной в настоящее время техники рекомбинантной ДНК выяснение места мутации одного или нескольких оснований — задача неимоверной трудности. Однако новые методы позволяют, вероятно, преодолеть большинство этих проблем.
Источник
