Клиника для лечения болезни вильсона коновалова
И.А. Иванова-Смоленская
профеcсор, доктор медицинских наук
ГУ НИИ неврологии РАМН
Болезнь Вильсона–Коновалова (гепато-лентикулярная дегенерация) относится к тяжелейшим наследственным болезням центральной нервной системы и внутренних органов. Если своевременно не начать лечение, направленное на выведение токсичных избытков меди из организма, то через 5–7 лет больной обречен на смерть. Болезнь поражает 25% братьев и сестер в семье при клинически здоровых родителях, которые являются носителями аномального гена (аутосомно-рецессивный тип наследования). Заболевают только те индивидуумы, которые унаследовали два мутантных гена, то есть по одному от матери и от отца – гомозиготные носители мутации; лица, которые от одного из родителей получили мутантный ген, а от другого – нормальный ген, являются гетерозиготными носителями мутации и остаются здоровыми.
Открытый недавно ген болезни отвечает за синтез медь-транспортирующего белка (АТР7В). При гепатолентикулярной дегенерации обмен меди и медьсодержащих белков нарушается, появляется избыток “свободной” меди, которая в больших количествах откладывается в печени, мозге, роговице, а также выделяется с мочой. Не случайно диагностика болезни базируется на обнаружении характерных нарушений медного обмена. Благодаря идентификации гена в настоящее время возможна и ДНК- диагностика этого заболевания.
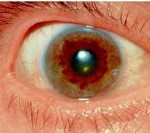
Поражение печени избытком “свободной” меди проявляется циррозом печени. Поражение мозга приводит к развитию тяжелой неврологической симптоматики: дрожанию конечностей и всего туловища, повышению мышечного тонуса, иногда сопровождающемуся болезненными спазмами, нарушением речи, глотания, снижению интеллекта. Отложение меди в роговице (по краю радужной оболочки) обусловливает формирование кольца Кайзера–Флейшера – буро-зеленоватого пигмента. По этому признаку диагноз болезни можно поставить безошибочно.
Гепато-лентикулярная дегенерация известна с глубокой древности. Дошедшее до нас изображение египетского фараона Тутанхамона, по мнению крупнейшего специалиста J. Walshe, не исключает вероятности, что он страдал этим заболеванием. Институт неврологии РАМН в течение многих лет занимается проблемой гепато-лентикуляной дегенерации. Знаменитый отечественный невролог академик АМН СССР Н.В. Коновалов, один из основателей Института, посвятил этому заболеванию две монографии, последняя из которых в 1964 году была удостоена Ленинской премии. В последующие годы данное заболевание продолжало успешно изучаться сотрудниками нейрогенетического отделения Института неврологии, под наблюдением которых за 40 лет находилось свыше500 семей, отягощенных этим недугом. Весь многолетний опыт Института свидетельствует о том, что ключевой проблемой является ранняя диагностика гепатолентикулярной дегенерации. Чем раньше начать лечение (в идеале – еще на досимптоматической стадии либо на доневрологическом этапе, то есть до появления признаков поражения мозга), тем лучше эффект. Вот почему, если в семье есть хоть один ребенок, страдающий этим заболеванием, необходимо тщательное обследование всех его братьев и сестер, в том числе с использованием самых современных биохимических и молекулярно-генетических методов.
Заподозрить раннюю стадию болезни можно на основании следующих признаков: перенесенной желтухи; повторных кровотечений из носа, кровоточивости десен либо множественных кровоподтеков; сосудистых “звездочек” на коже груди и спины; своеобразных “полосок” (белых, меняющих периодически окраску на красновато-синюшную) на бедрах и в подмышечных областях; гормональных нарушений в виде аменореи или дисменореи у девушек, гинекомастии (нагрубание грудных сосков) у юношей, а также акромегалии(увеличение носа, подбородка, утолщение губ); снижения интеллекта и изменений психики в виде чередования дурашливости и пониженного настроения, трудностей усвоения нового материала, проблем с успеваемостью в школе.
Гепато-лентикулярная дегенерация может начать проявляться в детском, подростковом, юношеском, зрелом возрасте и очень редко – в 50–60 лет. Чем раньше начинается заболевание, тем тяжелее оно протекает (при отсутствии лечения). Однако болезнь Вильсона–Коновалова – редкий пример наследственного нарушения, для которого разработаны высокоэффективные методы лечения: даже при появлении тяжелой неврологической симптоматики систематическое лечение обычно дает “драматический” эффект, вплоть до исчезновения всех симптомов или резкого их уменьшения. Пациенты вновь могут полностью обслуживать себя, вести домашнюю работу, учиться, работать по профессии, создать семью и родить здорового ребенка (под нашим наблюдением находятся 30 женщин, страдающих гепатолентикулярной дегенерацией и благополучно родивших здоровых детей). Пациентам с гепатолентикулярной дегенерацией необходимо регулярно наблюдаться у постоянного лечащего врача.
В чем же заключается лечение этой тяжелейшей болезни? Во-первых, это строгое соблюдение “печеночной” диеты (стол 5а), предполагающей исключение богатых медью продуктов (шоколад, кофе, орехи, бобовые и др.). Однако основное лечение – постоянный прием препаратов, выводящих медь из организма. Главным из них является D-пеницилламин.
Эти препараты назначаются по специальной схеме с постепенным увеличением дозы. К сожалению, в силу необходимости проведения пожизненного лечения и особых требований к химической чистоте препаратов отечественный аналог пеницилламина не может быть рекомендован при гепатолентикулярной дегенерации из-за высокой токсичности.
При длительном многолетнем приеме D-пеницилламина у некоторых больных гепатолентикулярной дегенерацией возникают побочные явления в виде дерматитов, анемии и иных осложнений. Поэтому был предложен альтернативный метод лечения солями цинка (оксид, сульфат и др.). Нами было предложено комбинированное лечение D-пеницилламином и препаратами цинка, что дает возможность снизить дозу и избежать побочных явлений. У больных в пресимптоматической стадии достаточно лечения только препаратами цинка.
В настоящее время за рубежом в тяжелых случаях болезни, не поддающихся консервативному лечению, широко применяется пересадка печени. При удачном исходе операции больной полностью выздоравливает и не нуждается в дальнейшем приеме препаратов. В России делаются первые шаги в этом направлении, и одним из таких шагов является разработанный нами совместно с Институтом трансплантологии и искусственных органов метод био-гемоперфузии с изолированными живыми клетками печени и селезенки – так называемый аппарат “вспомогательная печень”.
Помимо этих методов, большое значение имеет гепатопротекторная терапия, направленная на максимальное улучшение функций печени.
Таким образом, при правильной терапии гепатолентикулярной дегенерации – тяжелейшего наследственного заболевания мозга и внутренних органов – в 80% случаев возможно клиническое выздоровление либо выраженное улучшение состояния больных при условии своевременной максимально ранней диагностики.
© Журнал «Нервы», 2006, №4
Источник
Этиология и патогенез
В 1883 г. C. Westphal и A. Strumpell описали сочетающееся с циррозом печени хроническое прогрессирующее заболевание нервной системы, назвав его псевдосклерозом. В 1912 г. S. Wilson опубликовал подробное описание клинической картины болезни, а саму болезнь назвал прогрессирующей лентикулярной дегенерацией. H.Hall в 1921 г. показал, что за названиями «псевдосклероз» и «гепатолентикулярная дегенерация» скрывается одна и та же нозология и ввел термин «болезнь Вильсона».
В 1953 г. Bearn, проведя анализ 30 семей, где были пациенты с болезнью Вильсона, установил аутосомно-рецессивный тип наследования этого заболевания.
В 1956 г. Walshe продемонстрировал хелирующий эффект препарата
D-пеницилламина
. В 1974 г. Frommer привел доказательства нарушения процесса билиарной экскреции меди при болезни Вильсона-Коновалова.
Мутантный ген (ATP7B), детерминирующий развитие этого заболевания и расположенный на 13 хромосоме (локус13q14-q21), был открыт Frydman и др. в 1985 г.
В дальнейшем было установлено, что этот ген кодирует кодирует белок, ответственный за внутриклеточный транспорт ионов меди (транспортирующий медь АТФазный протеин Р-типа). Медь — важный микроэлемент, так как он входит в состав целого ряда ферментов в организме. Но избыток меди приводит к цитотоксическим эффектам, которые опосредованы окислительными повреждениями клеточных мембран, дестабилизацией ядерной ДНК, разрушением лизосом.
В настоящее время идентифицировано более 200 мутаций гена ATP7B, которые приводят к нарушениям билиарной экскреции меди и к накоплению этого микроэлемента сначала в печени, а затем и в других органах и тканях (ЦНС, почках, сердце, костно-суставной системе). В результате возникает токсическое поражение этих органов и нарушение их функций.
- Метаболизм меди в организме человека
- Патогенез болезни Вильсона-Коновалова
В патогенезе болезни Вильсона-Коновалова основную роль играет нарушение баланса между поступлением и экскрецией меди.
У пациентов с этим заболеванием процессы абсорбции меди в ЖКТ не нарушены, но отмечается значительное снижение активности процесса выведения меди с желчью, что приводит к накоплению этого микроэлемента в гепатоцитах.
Снижение экскреции меди болезни Вильсона-Коновалова связывается с дефицитом или полным отсутствием транспортирующего медь АТФазного протеина Р-типа (его детерминирует ген ATP7B), который в норме способствует транспорту меди в аппарат Гольджи и его высвобождению лизосомами в желчь.
При болезни Вильсона-Коновалова также нарушается включение меди в церулоплазмин, синтезируемый в печени, следствием чего является низкий уровень церулоплазмина в сыворотке крови (определение этого показателя имеет диагностическое значение).
Снижение билиарной экскреции меди при болезни Вильсона-Коновалова приводит к ее избыточному накоплению в организме. Первоначально медь накапливается в печени, поэтому заболевание чаще всего манифестирует с появления симптомов поражения именно этого органа (в 42% случаев). Как правило, у больных это происходит в возрасте 8-12 лет (иногда раньше), хотя уже с рождения у пациентов с болезнью Вильсона-Коновалова могут повышаться уровни печеночных аминотрансфераз.
После того как печень насыщается медью, что в ряде случаев происходит бессимптомно, накопление меди происходит в других органах и системах, прежде всего в ЦНС, в базальных ганглиях головного мозга (хвостатом ядре, скорлупе, бледном шаре), в которых содержание меди увеличивается в 50 и более раз по сравнению с нормой. Это приводит к возникновению нейропсихических нарушений, которые чаще всего наблюдаются во втором и третьем десятилетиях жизни.
При быстром поступлении больших количеств меди в кровь развивается значительная купремия, и медь, фиксируясь на мембране эритроцитов и образуя комплексы с белками, провоцирует развитие гемолитической анемии. Поэтому у 15% больных заболевание проявляется гематологическими синдромами, прежде всего гемолитической анемией.
Отложение меди в десцеметовой мембране роговицы проявляется формированием колец Кайзера-Флейшера. В роговице отложение меди происходит почти одновременно с появлением нейропсихической симптоматики (после насыщения медью печени). Накопление меди в десцеметовой мембране роговицы приводит к образованию пигментации желто-коричневого (иногда зеленоватого) цвета: кольца Кайзера-Флейшера.
Не связанная с церулоплазмином (свободная) медь вызывает внепеченочное повреждение тканей почек, сердца, суставов.
- Токсическое действие меди
- Патоморфология при болезни Вильсона-Коновалова
- Патогенетические стадии болезни Вильсона-Коновалов
- Начальный период накопления меди (преимущественно в печени).
- Распределение меди в печени и начало выхода в системный кровоток.
- Накопление меди в головном мозге и других органах.
- Достижение баланса меди благодаря хелирущей терапии.
Вернуться к оглавлению
Источник

Болезнь Вильсона — наследственное заболевание, передающееся по аутосомно-рецессивному типу. Возникает в условиях мутаций в гене АТР7В, кодирующем белок медьтраснпортирующей АТФазы печени. Характерный признак болезни Вильсона — накопление меди в различных органах и тканях, в большей степени в печени и базальных ганглиях. Болезнь Вильсона может протекать в брюшной, ригидно-аритмогиперкинетической, дрожательной или экстрапирамидно-корковой форме. Диагностика болезни Вильсона включает офтальмологическое обследование, биохимические анализы мочи и крови, МРТ или КТ головного мозга. Основу патогенетической терапии составляют тиоловые препараты, которые могут приниматься в течении нескольких лет и даже пожизненно.
Общие сведения
Болезнь Вильсона — наследственное заболевание, передающееся по аутосомно-рецессивному типу. Возникает в условиях мутаций в гене АТР7В, кодирующем белок медьтраснпортирующей АТФ-азы печени. Характерный признак болезни Вильсона — накопление меди в различных органах и тканях, в большей степени в печени и базальных ганглиях. Первооткрыватель заболевания — А.К. Вильсон, описавший заболевание в 1912 году, в отечественной медицине — Н.А. Коновалов. Патогенез болезни Вильсона был выявлен в 1993 году. Понятию «болезнь Вильсона» соответствуют также: болезнь Вильсона-Коновалова, болезнь Вестфаля-Вильсона-Коновалова, дистрофия гепатоцеребральная, дистрофия гепатолентикулярная, дегенерация лентикулярная прогрессирующая.
Болезнь Вильсона
Причины
Ген АТР7В картирован на длинном плече хромосомы 13 (13q14.3-q21.1). Организм человека содержит около 50-100 мг меди. Суточная потребность меди для человека — 1-2 мг. 95% абсорбированной в кишечнике меди, транспортируется в форме комплекса с церулоплазмином (один из глобулинов сыворотки, синтезируемых печенью) и только 5% в форме комплекса с альбумином. Кроме того, ион меди входит в состав важнейших метаболических ферментов (лизилоксидаза, супероксиддисмутаза, цитохром-С-оксидаза и др.). При болезни Вильсона происходит нарушение двух процессов обмена меди в печени — биосинтез главного медьсвязывающего белка (церулоплазмина) и выведение меди с желчью, следствием чего становится повышение уровня несвязанной меди в крови. Концентрация меди в различных органах (чаще всего в печени, почках, роговице и головном мозге) увеличивается, что приводит к их токсическому поражению.
Классификация
Согласно классификации Н.В. Коновалова различают пять форм болезни Вильсона:
- брюшная
- ригидно-аритмогиперкинетическая
- дрожательно-ригидная
- дрожательная
- экстрапирамидно-корковая
Симптомы
Для болезни Вильсона характерен клинический полиморфизм. Первые проявления заболевания могут появиться в детстве, юношестве, в зрелом возрасте и гораздо реже в зрелом возрасте. В 40-50% случаев Болезнь Вильсона манифестирует с поражения печени, в остальных — с психических и неврологических расстройств. С вовлечением в патологический процесс нервной системы обнаруживается кольцо Кайзера-Флейшера.
Брюшная форма развивается преимущественно до 40 лет. Характерный признак — тяжелое поражение печени по типу цирроза печени, хронического гепатита, фульминантного гепатита.
Ригидно-аритмогиперкинетическая форма манифестирует в детском возрасте. Начальные проявления — мышечная ригидность, амимия, смазанность речи, трудности при выполнении мелких движений, умеренное снижение интеллекта. Для этой формы заболевания характерно прогрессирующее течение, с наличием эпизодов обострения и ремиссии.
Дрожательная форма возникает в возрасте от 10 до 30 лет. Преобладающим симптомом является тремор. Кроме того, могут наблюдаться брадикинезия, брадилалия, тяжелый психоорганический синдром, эпилептические приступы.
Экстрапирамидно-корковая форма встречается весьма редко. Ее начало схоже с началом какой-либо из вышеперечисленных форм. Для нее характерны эпилептические припадки, экстрапирамидные и пирамидные нарушения и выраженный интеллектуальный дефицит.
Диагностика
Офтальмологическое исследование с помощью щелевой лампы выявляет кольцо Кайзера-Флейшера. Биохимические исследования мочи обнаруживают повышенную экскрецию меди в суточной моче, а также снижение концентрации церулоплазмина в крови. С помощью визуализационных методов (КТ и МРТ головного мозга) обнаруживают атрофию полушарий большого мозга и мозжечка, а также базальных ядер.
При диагностике болезни Вильсона неврологу необходимо дифференцировать ее от паркинсонизма, гепатоцеребрального синдрома, болезни Геллервордена-Шпатца. Основным дифференциально-диагностическим признаком этих заболеваний является отсутствие характерных для болезни Вильсона кольца Кайзера-Флейшера и расстройств обмена меди.
Лечение болезни Вильсона
Основой патогенетического лечения является назначение тиоловых препаратов, в первую очередь — D-пеницилламина либо унитиола. Главное преимущество купренила — низкая токсичность и возможность длительного приема при отсутствии побочных эффектов. Его назначают по 0,15 г (1 капсула) в сутки (только после еды), в дальнейшем, в течение 2,5-3 месяцев дозу увеличивают до 6-10 капсул/сутки (оптимальная доза). Лечение D-пеницилламином проводится годами и даже пожизненно с небольшими перерывами (на 2-3 недели) в случае появления побочных эффектов (тромбоцитопения, лейкопения, обострения язвенной болезни желудка и т. д.).
Унитиол назначают в случае непереносимости (плохой переносимости) D-пеницилламина. Длительность одного курса лечения — 1 месяц, после чего лечение приостанавливают на 2,5-3 месяца. В большинстве случаев наступает улучшение общего состояния пациента, а также регресс неврологических симптомов (скованности, гиперкинезов). В случае доминирования гиперкинезов рекомендовано назначение небольших курсов нейролептиков, при ригидности — леводопы, карбидопы, тригексифенидила.
В случае тяжелого течения болезни Вильсона, при неэффективности консервативного лечения за рубежом прибегают к трансплантации печени. При положительном исходе операции состояние пациента улучшается, восстанавливается обмен меди в организме. В дальнейшем лечение пациента составляет иммуносупрессивная терапия. В России на сегодня постепенно внедряется в клиническую практику метод биогемоперфузии с изолированными живыми клетками селезенки и печени (т. н. аппарат «вспомогательная печень). Немедикаментозное лечение состоит в назначении диеты (стол №5) в целях исключения продуктов богатых медью (кофе, шоколад, бобовые, орехи и т. д.).
Прогноз и профилактика
В случае своевременного диагностирования болезни Вильсона и проведения адекватной медьснижающей терапии возможна нормализация общего состояние пациента и обмена меди в организме. Постоянный прием тиоловых препаратов по схеме, назначенной врачом-специалистом, позволяет поддерживать профессиональную и социальную активность пациента.
Для предотвращения рецидивов болезни Вильсона рекомендовано проведение лабораторных исследований крови и мочи пациента несколько раз в год. Необходим контроль следующих показателей: концентрация меди, церулоплазмина и цинка. Кроме того, рекомендовано проведение биохимического анализа крови, общего анализа крови, а также регулярные консультации у терапевта и невролога.
Источник
