Методы и исследования инфекционных болезней у животных
При подозрении на инфекционную болезнь в хозяйстве основная задача врача-эпизоотолога — своевременно установить диагноз, используя комплексный метод диагностики.
Иммунологический:
Аллергическая проба (внутрикож-ная, глазная, подкожная) серологический (РА, РГА, РНГА, РТГА, РТНГА, ККРА, ККРНГА, РСК, РДСК, РИФ, РЗГАд, РНГАд, РП, РДП, РН, ‘ РИД, РБП, РИА, . ИФА, РФ, РИЭОФ, КР с молоком, РБП)
Комплексный метод диагностики инфекционных болезней
Эпизоотологический Клинический
Патоморфологический:
Патологоанатомический гистологический
Бактериологический:
Микроскопия (световая, люминесцентная)
Выделение возбудителя
Биопроба
Вирусологический:
Микроскопия (люминесцентная, световая, электронная)
Выделение вируса биопроба
Гематологический
Примечание. Для каждой болезни существует перечень показателей, по которым диагноз считают установленным.
Благодаря правильному и своевременному диагнозу удается обеспечить эффективность оздоровительных мероприятий, т. е. быстро купировать возникший эпизоотический очаг и предупредить дальнейшее распространение болезни.
Эпизоотологический метод. Представляет собой систему изучения проявлений эпизоотического процесса. Для характеристики последнего необходимо собрать точную информацию о восприимчивых видах, источнике и резервуаре возбудителя болезни, механизме его передачи, воротах инфекции, интенсивности проявления эпизоотического процесса, сезонности, предрасполагающих факторах, заболеваемости, смертности, летальности. Кроме того, особое внимание обращают на факторы, определяющие пути дальнейшего распространения заболевания — выполнение противоэпизоотических мероприятий и условия внешней среды.
Чтобы охарактеризовать эпизоотическое состояние хозяйства, сопоставляют и оценивают обобщенные эпизоотологические показатели, получаемые путем статистической обработки данных первичного учета заболеваний и профилактических мероприятий.
Клинический метод. При клиническом исследовании животных, подозреваемых в заболевании инфекционной болезнью, необходимо всегда строго соблюдать правила работы, предусмотренные соответствующей инструкцией.
Клиническое исследование рекомендуют начинать с измерения температуры тела животного. Далее осматривают животное в нефиксированном состоянии: обращают внимание на положение тела реакцию на различные раздражители, прием корма и воды, характер фекалий, особенности дефекации и мочеиспускания. Затем приступают к исследованию отдельных систем и органов по схеме, общепринятой в клинической диагностике болезней.
Клинические признаки инфекционной болезни зависят от многих факторов: вида и локализации возбудителя, течения, формы проявления и стадии болезни, резистентности организма и других причин. Во всех случаях клинические признаки одной и той же инфекционной болезни у животных даже одного вида сильно варьируют.
Патоморфологический метод. Включает в себя патологоанатомический и гистологический методы исследований. Патологоанатомический метод считают важным, но не всегда окончательным методом диагностики. Например, если при вскрытии трупа животного (птицы) отмечают характерные изменения — туберкулы, то сразу же диагностируют туберкулез, при обнаружении в селезенке свиньи краевых геморрагических инфарктов — чуму, кровоизлияний на границе мышечного и железистого желудка у кур — болезнь Ньюкасла и т. д.
Порядок патологоанатомического исследования: оценивают состояние трупа, кожи и слизистых оболочек, затем исследуют лимфатическую систему, серозные покровы, мышцы и суставы, органы дыхания, сердце и кровеносные сосуды, печень, селезенку, почки, глотку, пищевод, желудок, тонкий кишечник, толстый кишечник, мочевой пузырь, органы воспроизводства, головной и спинной мозг.
Однако во многих случаях наряду с патологоанатомическим применяют и метод лабораторных исследований (гистологических, бактериологических и др.). С помощью гистологического метода устанавливают точный диагноз при таких болезнях, как — бешенство (тельца Бабеша—Негри), ринопневмония (внутриядерные включения типа Коудри), оспа (тельца-включения).
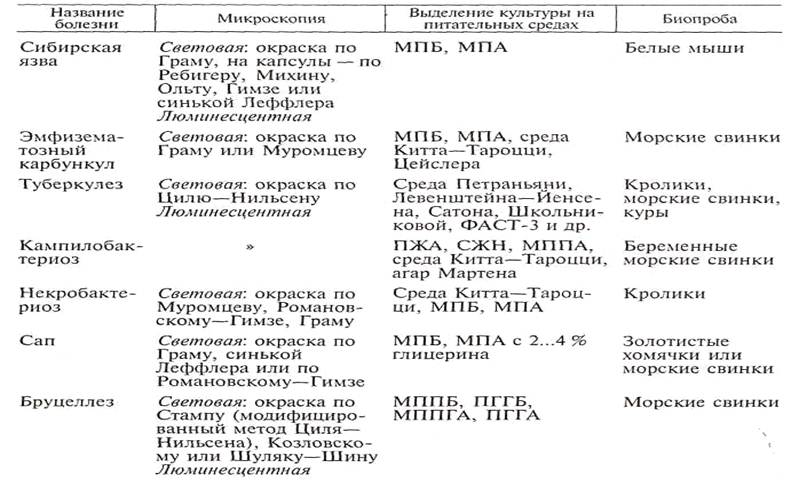
Бактериологический метод. Это ценный метод диагностики инфекционных болезней. Для бактериологического исследования от больных или павших животных необходимо правильно взять патологический материал и грамотно оформить сопроводительный документ. Поступивший биоматериал обрабатывают в зависимости от предполагаемой болезни, делают мазки-отпечатки, красят их соответствующими методами, выделяют чистую культуру посевом на питательные (элективные) среды, заражают чувствительных лабораторных животных биоматериалом или выделенной чистой культурой (табл.1).
1. Бактериологический метод диагностики некоторых инфекционных болезней

На основании обнаружения патогенных микроорганизмов в поступившем материале устанавливают этиологический диагноз.
Вирусологический метод. Для вирусологического исследования в лабораторию направляют патологический материал от больных животных, взятый в период проявления у них клинических признаков (температурная реакция, угнетение, воспалительные процессы в верхних дыхательных путях, сопровождающиеся серозными или слизистыми истечениями из носовой полости, диарея, образование везикул, афт, иногда аборты), или вынужденно убитых (павших) животных, взятый не позднее чем через 2 ч после их гибели. Вирусологический метод диагностики включает в себя: обнаружение возбудителя в патологическом материале различными методами (электронная, люминесцентная или световая микроскопия, заражение культуры клеток, лабораторных животных и т. д.), выделение и идентификацию вируса в различных серологических реакциях, биопробу.
Гематологический метод. В лабораторию для гематологического исследования отправляют кровь, которую берут с соблюдением правил асептики из яремной вены в пробирки с антикоагулянтом— 10 %-м раствором трилона Б, гепарина, цитрата натрия из расчета 0,02 мл раствора на 1 мл крови.
Гематологический метод используют как вспомогательный, а при некоторых инфекционных болезнях (лейкоз крупного рогатого скота, инфекционная анемия лошадей) — в качестве основного метода диагностики. При лейкозе крупного рогатого скота диагноз основан на обнаружении в периферической крови повышения содержания лейкоцитов основного лимфоидного ряда в 1-10-3 мл крови, а при инфекционной анемии лошадей — на основании снижения содержания эритроцитов в 1 • 103 мл крови, гемоглобина и замедленной скорости оседания эритроцитов (СОЭ).
Иммунологический метод. Включает в себя серологическую диагностику — в лаборатории исследуют сыворотки крови для обнаружения антител и аллергическую пробу, с помощью которой в хозяйствах выявляют животных, больных туберкулезом, паратуберкулезом, бруцеллезом, сапом, реже — сибирской язвой, листериозом, туляремией.
Источник
Радюк Екатерина Васильевна – врач-лаборант ИВЦ МВА
Инфекционные заболевания весьма часто встречаются в ветеринарной практике. Для владельца животного важно вовремя обратить внимание на симптомы недомогания питомца. Для большинства инфекционных заболеваний эти симптомы неспецифичны: угнетение, отказ от корма, повышенная температура тела, рвота, понос; при некоторых заболеваниях встречается хромота и опухание суставов; возможно изменение цвета мочи.
Для ветеринарного врача, к которому приводят заболевшее животное, важно составить список дифференциальных диагнозов и исключить (или подтвердить) их специальными методами диагностики. Однако стоит помнить, что выбор диагностического метода будет зависеть от вида возбудителя, его локализации и стадии заболевания. Методика, применимая для диагностики одной инфекции, совершенно неприемлема для диагностики другой.
В данной статье представлен обзор основных методов диагностики инфекционных заболеваний, которыми располагает современная ветеринарная медицина.
1. Культивирование
Целью данного метода является изоляция возбудителя и получение его чистой культуры на специальной среде в оптимальных условиях. Наряду со световой микроскопией культивирование микроорганизмов является «классическим» методом диагностики. Успешное выделение и культивирование возбудителя из клинического материала позволяет подтвердить этиологию заболевания на ранних сроках до появления специфических антител и идентифицировать возбудитель. Однако у этого метода есть свои, достаточно значимые для клинической практики, ограничения.
Возбудители многих заболеваний, как правило, достаточно требовательны к питательным средам и достаточно сложны для культивирования invitro. Не для всех возбудителей определены условия культивирования. В некоторых случаях используют синтетические или полусинтетические среды – однако при этом рост возбудителей очень медленный (до нескольких месяцев) и всегда присутствует значительный риск грибковой или бактериальной контаминации, несмотря строгое соблюдение асептики. Кроме того, проведение работ по культивированию возможно только в специализированных микробиологических лабораториях. Поэтому в ветеринарии данный метод не нашел широкого применения при диагностике инфекционных заболеваний; работы, связанные с культивированием возбудителей, проводятся, как правило, только в специальных исследовательских институтах с целью их более детального изучения и разработки диагностических тест-систем.
2. Световая микроскопия
1) Микроскопия фиксированных окрашенных препаратов
Является наиболее доступным и потому распространенным методом диагностики инфекционных (особенно трансмиссивных) заболеваний в ветеринарной медицине. Основан на выявлении возбудителя в клиническом материале по характерной морфологии. Однако, несмотря на свою простоту и доступность, у этого метода есть свои недостатки.
Во-первых, у метода световой микроскопии достаточно ограниченная чувствительность. При незначительном количестве возбудителей в материале результат микроскопии может быть отрицательным.
Во-вторых, необходимо тщательное приготовление и окраска мазков для минимизации возможных артефактов.
В-третьих, лаборанту или врачу, интерпретирующему мазок, требуется достаточный опыт и хорошее знание морфологии как клеток тканей, так и возбудителей и умение отличать последних от возможных рефракционных артефактов или преципитатов красителя. И, в-четвертых, точное определение вида возбудителя при использовании только световой микроскопии возможно далеко не всегда. Поэтому световую микроскопию стараются дополнять другими методами диагностики, основанными на обнаружении специфических антител либо генетического материала возбудителя.
2)Темнопольная микроскопия
Вид оптической микроскопии, в которой контраст изображения увеличивают за счет регистрации только света, рассеянного изучаемым образцом. Как правило, используется для обнаружения спирохет — боррелий и лептоспир. Из-за необходимости наличия специального оборудования в рутинной ветеринарной практике применяется редко. Кроме того, с помощью темнопольной микроскопии невозможно определить видовую принадлежность возбудителя и его патогенность.
3. Полимеразная цепная реакция (ПЦР)
Полимеразная цепная реакция (ПЦР) – это метод ферментативного получения ампликонов (большого количества копий) исследуемых фрагментов ДНК путем повторных циклов репликации и денатурации (разделения цепи ДНК на отдельные нити); при этом происходит копирование только исследуемого участка ДНК (при условии его присутствия в данном образце), поскольку только этот участок соответствует заданным условиям.
Метод ПЦР идеально подходит для обнаружения микроорганизмов, трудно визуализирующихся, медленно растущих или сложных в культивировании. ПЦР является наиболее предпочтительным методом для диагностики заболевания в острый период. Основным лимитирующим фактором при использовании ПЦР является содержание в исследуемой пробе достаточного количества материала (нуклеиновой кислоты возбудителя). Для многих возбудителей известно, что их количество в крови меняется с течением времени; таким образом, в какой-то момент времени ПЦР может показать ложноотрицательный результат у инфицированного пациента. Таким образом, для врача крайне важно знать тропность возбудителя к тканям организма и отправлять на исследование тот материал, в котором вероятность обнаружения возбудителя наиболее высока (например, мочу – при диагностике лептоспироза, плаценту или пунктат семенников при подозрении на бруцеллез, синовиальную жидкость — при исследовании на боррелиоз).
К техническим недостаткам этого метода можно отнести возможность ложноотрицательных результатов из-за присутствия ингибиторов реакции в пробе, а также возможность ложноположительных результатов вследствие контаминации. Кроме того, данный метод не всегда подходит для оценки эффективности лечения, поскольку ПЦР выявляет как живые микроорганизмы, так и их «останки».
4. Серологические методы диагностики
Данные методы основаны на выявлении у животных специфических антител. Заражение инфекционным агентом, если оно происходит впервые, в течение недели вызывает у животного умеренный рост иммуноглобулинов класса М (IgM) и постепенное увеличение иммуноглобулинов класса G (IgG), которое достигает пика через 14 дней. Определение уровня антител у животных с остро начинающимся заболеванием (таким как бабезиоз) дает мало полезной диагностической информации. Для диагностики хронических заболеваний (например, моноцитарного эрлихиоза) измерение уровня антител будет более полезным.
Продукция антител у каждого животного может сильно варьироваться; этот процесс зависит от возраста, иммунного статуса и генетической принадлежности. Лучший способ оценки степени сероконверсии заключается в исследовании парных сывороток, взятых с интервалом в 2-3 недели. Растущий титр антител указывают на недавнюю и, следовательно, клинически значимую инфекцию, особенно если это подтверждается соответствующими клиническими признаками. Альтернативным методом определения недавней инфекции является измерение уровня IgM, однако в ветеринарной практике данный метод практически не используется.
1) Твердофазный иммуноферментный анализ (ИФА, ELISA)
Принцип метода заключается в том, один их специфических реагентов (антиген) иммобилизуют на твердой фазе. Затем последовательно добавляют другие специфические реагенты, проводя после инкубации каждого из них промывку с целью удаления несвязавшихся компонентов. Один из специфических реагентов, так называемый конъюгат, содержит ферментную метку. Для визуализации результата в конце реакции добавляют хромогеновый субстрат. Через определенный промежуток времени реакцию останавливают и проводят считывание на спектрофотометре.
Для определения титра антител в сыворотке готовят несколько последовательных разведений; титр антител определяется как обратный последнему видимому разведению (к примеру, если последнее разведение было 1:2000, то титр антител составит 2000). Метод твердофазного ИФА является наиболее предпочтительным для определения наличия антител к возбудителям, антигены которых легкодоступны (т.е. это либо легко культивируемые микроорганизмы, либо те, для которых получены рекомбинантные антигены). Кроме того, он может использоваться и для выявления антигенов возбудителя – например при диагностике инвазии Dirofilariaimmitisили вируса лейкемии кошек.
Для использования полноценного твердофазного иммуноферментного анализа необходимо наличие специального лабораторного оборудования. Однако существует экспресс-модификация ИФА (SNAP, IDEXX Laboratories), где антиген/антитела иммобилизированы не на плашке, а на мембранном фильтре. Эти тесты широко используются в клиниках для диагностики трансмиссивных заболеваний (лейшманиоза, дирофиляриоза, анаплазмоза, эрлихиоза и боррелиоза). Однако они не дают возможность зафиксировать рост или снижение титра антител, а также определить их принадлежность к M или G классу.
2) Метод флюоресцирующих антител (МФА, IFA)
В случае, когда культивирование микроорганизма сопряжено с техническими сложностями либо небезопасно, применяют метод иммунофлюоресценции. При этом может быть обнаружен как сам организм в зараженных клетках и тканях пациента (прямой МФА) либо наличие в сыворотке специфичных антител (непрямой МФА). В непрямом МФА зараженные клетки (как правило, культурального происхождения) зафиксированы на предметных стеклах либо планшетках. Сама процедура исследования схожа с таковой в ИФА. Однако в конъюгате вместо фермента здесь используется специальный краситель, дающий при определенной длине волны флюоресцентное свечение, которое можно видеть в специальный микроскоп. Количество антител также определяется по последнему разведению, давшему положительный результат.
Прямой МФА считается менее чувствительным; используется в тех случаях, когда число зараженных клеток невелико (например, для выявления в мазках крови морул Anaplasmaphagocytophilum).
3) Иммуноблот (вестерн-блот)
Представляет собой метод, при котором возможна визуализация взаимодействия антител с каждым антигеном в отдельности. Антигены возбудителя отделяются друг от друга с помощью электрофореза, а затем в виде полос наносятся на специальную мембрану (обычно нитроцеллюлозную). Дальнейшие стадии аналогичны таковым в ИФА. Для детекции результатов обычно используют иммунопероксидазный метод; при этом комплексы антиген-антитело визуализируются как отдельные темные полосы. Таким образом, можно понять, на какие именно антигены возбудителя в организме животного выработались антитела. Наибольшее значение метод иммуноблоттинга имеет при диагностике клещевого боррелиоза (болезни Лайма), поскольку метод ИФА при этом часто дает ложноположительные результаты. Кроме того, этот метод считается «золотым стандартом» при диагностике вирусного иммунодефицита кошек.
4) Иммунохроматография (ИХА, «экспресс-тесты»)
По этому принципу сделано большое количество «быстрых тестов», широко используемых в ветеринарных клиниках. Полученная от животного сыворотка наносится на мембрану, содержащую связанный с молекулами золота антиген. Специфичные антитела в сыворотке связываются с антигеном; образовавшийся в результате комплекс антиген-антитело продвигается с током жидкости по тестовой зоне, пока не достигнет матрикса, который его связывает. Данный комплекс выглядит как розовая полоса в зоне преципитации. Аналогично выглядит положительный контроль. Результат, выдаваемый тестами, как правило, является качественным – то есть нарастание или снижение уровня антител по ним отследить невозможно. Некоторые тесты (например, для диагностики парвовирусного и коронавирусного энтерита, лейкемии кошек, сердечного дирофиляриоза) выявляют наличие в сыворотке соответствующего антигена – в таком случае результат является качественным.
Таким образом, в статье были рассмотрены основные методы, применяемые сегодня для диагностики инфекционных заболеваний животных. Особое внимание хотелось бы уделить тому, что не существует какого-либо универсального метода для диагностики того или иного заболевания. Поэтому от врача при постановке диагноза требуется комплексный подход; необходимо учитывать анамнез, длительность заболевания, клинические признаки и данные общих лабораторных исследований.
Кроме того, необходимо умение правильно интерпретировать результаты – ведь даже обнаружение антител (особенно класса G) к тому или иному возбудителю не говорит о том, что именно этот этиологический агент является причиной нынешнего состояния животного. Только грамотное применение и интерпретация специальных методов исследования (не только при диагностике трансмиссивных заболеваний) в сочетании с клинической картиной дает возможность правильно поставить диагноз и назначить адекватное лечение.
Вернуться к списку
Источник
