Миелодиспластический синдром история болезни по гематологии
ФГАОУ ВПО «Северо – Восточный федеральный университет
им. М.К. Аммосова»
Медицинский институт
Кафедра «Госпитальная терапия, профессиональные болезни и клиническая фармакология»
История болезни:
Мурзина Лидия Константиновна
Выполнила: студентка V курса,
группа ЛД 503-1
Шишигина Анастасия Ивановна
Проверила: к.м.н. Ядрихинская В.Н.
Якутск 2017
ПАСПОРТНАЯ ЧАСТЬ
Датапоступления: 22.03.2017.
Ф.И.О. больного(ой): Мурзина Лидия Константиновна
Дата рождения, возраст: 07.04.1955, 61 год
Постоянное место жительство: г. Ленск, ул. Интернациональная, 2/3, кв. 12
Место работы: не работает, пенсионерка
Семейное положение: не замужем
Образование: среднее техническое
Кем направлена: Республиканский КДЦ
Диагноз направившего учреждения: Миелодиспластический синдром. Рефрактерная анемия.Диагноз при поступлении: D46,2 Миелодиспластический синдром. Рефрактерная анемия с избытком бластов
Диагноз клинический:D46,2 Миелодиспластический синдром. Рефрактерная анемия с избытком бластов
ЖАЛОБЫ
На общую слабость, утомляемость, потливость, повышение температуры тела до 38,6*С, снижение веса на 5-6 кг в течение 2 месяцев, боли в области тазобедренных суставов с обеих сторон.
АНАМНЕЗ БОЛЕЗНИ
Считаетсебя больной с начала февраля 2017г., когда отметила выраженный астенический синдром: нарастание слабости, одышки, потливости и рецидивирующих носовых кровотечений. Обратилась к врачам по поводу слабости и рецидивирующих носовых кровотечений. В анализах крови от 06.03.2017г.: гемоглобин от 50-70 г/л, эритроциты 2,0-2,22х10/л, тромбоциты 29-24х10/л. С подозрением на острый лейкоз былагоспитализирована в ОГ КЦ 06.03.2017г. В ходе обследования был верифицирован диагноз – МДС, РАИБ-1. Проводилась гемостатическая, гемотрансфузионная, антибактериальная, противогрибковая терапия. С некоторым положительным эффектом была выписана на наблюдение гематолога ККО. Поступает для дальнейшего лечения, установки PORT-системы.
АНАМНЕЗ ЖИЗНИ
Перенесенные заболевания: страдает АГ, анемией, гастритом. Гепатит и туберкулезотрицает.
Перенесенные операции: Переливание крови в анамнезе с этого года. В 1987 году операция удаления зоба по поводу ДУЗ. Операция по поводу удаления варикозно расширенных вен в 2002 г.
Наследственность: не отягощена.
Аллергологический анамнез: не отягощен.
Вредные факторы: отсутствуют.
Дополнительная информация: роды 3, без осложнений, без переливания крови, менопауза.
ОБЪЕКТИВНЫЕ ДАННЫЕДанные физического развития: рост 155 см, вес 64 кг, индекс массы тела 27.
Состояние больного: тяжелой степени тяжести.
Телосложение: нормостеническое.
Положение больного: активное.
Кожные покровы и слизистые оболочки: чистые, розовые, геморрагии в местах инъекций. Высыпания: нет.
Периферические лимфоузлы: передние шейные увеличены.
Периферические отеки: нет. ЧСС 90 уд в мин, АД 140/80.
Частотадыхательных движений: 18 в мин., равномерное. Тип дыхания: грудной. Перкуторный звук над легкими: ясный, легочной. Аускультация легких: проводится, хрипов нет. Костно-мышечная система: не изменена.
Глотание: не затруднено. Ротоглотка: на мягком небе петехии. Язык: влажный, обложен белым налетом. Аускультация живота: перистальтика кишечника выслушивается. Живот: безболезненный мягкий. Печень: непальпируется. Селезенка: не пальпируется. В позе Ромберга: устойчива.
ДАННЫЕ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ
1. ОБЩИЙ АНАЛИЗ КРОВИ
2. МИЕЛОГРАММА (ГРУДИНА) – 22.03.17
3. ИММУНОФЕНОТИПИРОВАНИЕ СЫВОРОТКИ – 22.03.17
По данным проточной цитометрии картина костного мозга трансформирована, обращает на себя внимание популяция клеток низкой гранулярности со сниженной экспрессией CD45dim, и экспрессией CD34+бласты = 20%, гомогенно экспрессирующие миелоидные маркеры CD33+ CD13+ CD117+. Экспрессия МРО не выявлено в 13% бластах и расценена как положительная трансформированные клетки негативны по экспрессии Т и В ассоциированных антигенов. Суммарный фенотип трансформированных клеток CD45dim+ CD34+ HLADR+ MPO+CD13+CD117+ CD38 + CD7 – CD14 — CD14 – CD64 – CD15…
Источник
Для цитирования: Нурмухаметова Е. ГЕМАТОЛОГИЯ. МИЕЛОДИСПЛАСТИЧЕСКИЕ СИНДРОМЫ. РМЖ. 1998;6(11):8.
Термин «миелодиспластический синдром» был введен в 1975 г. FAB-группой, в составе которой гематологи из Франции, Америки и Великобритании, для описания ряда заболеваний, характеризующихся определенными изменениями в периферической крови, нарушением функции костного мозга и частой прогрессией в острый миелолейкоз. Данные по распространенности миелодиспластического синдрома (МДС) в различных возрастных группах представлены на рисунке.
Таблица 1. Морфологические изменения при МДС
Росток кроветворения | Кровь | Костный мозг |
| Эритроидный | Овальные макроциты | Нарушение формы ядра и расположения хроматина |
| Миелоидный | Зернистость базофилов | Кольцевидные сидеробласты |
| Гипогранулярные нейтрофилы | ||
| Гипосегментарные ядра нейтрофилов | ||
| Мегакариоцитарный | Агранулярные тромбоциты | |
| Микромегакариоциты | ||
| Мононуклеарные мегакариоциты | ||
| Мегакариоциты с разделенными ядрами |
Этиология
Выделяют первичный МДС и МДС, обусловленный предшествующей терапией. В первом случае причина заболевания неясна; во втором случае возникновение МДС рассматривают как следствие цитотоксической терапии (хлорамбуцил, циклофосфамид) в анамнезе.
Таблица 2. FAB-классификация МДС
| Категория | Периферическая кровь | Костный мозг | |
| Рефрактерная анемия | <1% бластов | и | <5% бластов |
| Рефрактерная анемия с кольцевидными сидеробластами | <1% бластов | и | <5% бластов, >15% кольцевидных сидеробластов |
| Рефрактерная анемия с избытком бластов | <5% бластов | и | 5 – 20% бластов |
| Рефрактерная анемия с избытком бластов в трансформации | >5% бластов | или | 21 – 30% бластов |
| Хронический миеломоноцитарный лейкоз | >1.109/л моноцитов |
Диагностика
У пациентов развивается недостаточность костного мозга, которая проявляется анемией, бактериальными инфекциями, кровотечениями. У 10% больных отмечается спленомегалия. В клиническом анализе крови возможны такие изменения, как снижение гемоглобина, макроцитоз, нейтропения, моноцитоз, тромбоцитопения. Для подтверждения диагноза производят пункцию костного мозга. Изменения, выявляемые при этом, отражены в табл. 1.
Важно помнить о том, что морфологические проявления дисплазии нельзя отождествлять с МДС, так как исходные изменения могут отмечаться при недостаточности витамина В12, фолатов, при злоупотреблении алкоголем, после цитотоксической химиотерапии, при ВИЧ-инфекции. В небольшом количестве измененные клетки встречаются и у здоровых людей.
Если морфологические данные недостаточны для окончательного подтверждения МДС, показано проведение цитогенетических исследований. Хромосомные аномалии встречаются примерно в 30 – 50% случаев при первичном МДС и в 80 % – при вторичном МДС. Некоторые хромосомные аномалии ассоциируются с определенными клиническими проявлениями.
Например, потеря части длинного плеча 5 хромосомы связана с развитием макроцитарной анемии у пожилых женщин и с низким риском трансформации в острый миелолейкоз.
FAB-классификация
Классификация МДС представлена в табл. 2.
Течение и прогноз
Клиническое течение МДС отличается большим разнообразием. Примерно две трети больных погибают вследствие недостаточности костного мозга. Медиана продолжительности жизни в целом составляет 20 мес. Прогноз для каждого пациента определяется количеством бластов в костном мозге, количеством и особенностями хромосомных аномалий и количеством заинтересованных ростков кроветворения.
Лечение
Большинству пациентов может быть предложено лишь паллиативное лечение. Однако в отношении больных молодого возраста, перспективных в плане аллогенной трансплантации костного мозга, возможно полное излечение. Пятилетняя выживаемость в этих случаях составляет 40% при изначально повышенном количестве бластов в костном мозге и 60% – если такого повышения нет.
При низком риске показано наблюдение. При среднем или высоком риске для лиц моложе 65 – 70 лет перспективной является интенсивная химиотерапия. Ремиссия достигается примерно в 60 % случаев, но ее продолжительность редко превышает 18 мес.
Возможно, что широкое распространение для лечения МДС получат препараты, способствующие дифференцированию незрелых клеток (цитозар в низких дозах, аналоги витамина D3, ретиноевая кислота).
Для повышения содержания кровяных клеток применяют переливание препаратов крови. В этих же целях могут быть использованы различные колониестимулирующие факторы. Однако эти препараты дорогостоящи и неэффективны при тяжелых цитопениях.
Литература:
Oscier DG The myelodysplastic syndromes BMJ 1997;314:883–6.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Поделитесь статьей в социальных сетях
Источник
Что такое миелодиспластический синдром? — история изучения
Первое описание хронической анемии в сочетании с дисплазией и гиперплазией эритроидного ростка, которой было дано определение «псевдоапластическая анемия», относится к 1907 г.. Несколько позже появились публикации, указывающие на случаи анемии с анизоцитозом, гиперплазией эритроидного ростка в трепанобиоптате костного мозга и выявлением в анализе крови дисплазии эритроцитов, лейкоцитов и тромбоцитов.
Больные с данными симптомами обычно умирали в результате выраженной анемии, геморрагического синдрома, инфекций и развития острого лейкоза. Эти состояния обозначались как «тлеющий острый лейкоз», «лейкоанемия», «гемопоэтическая дисплазия», «малопроцентный лейкоз», «сидероахрестическая анемия».
В 1938 г. С. P. Rhoads и W. H. Barker при анализе подобных наблюдений использовали термин «рефрактерная анемия». В дальнейшем J. L. Hamilton-Peterson в 1949 г. и М. Block и соавт. в 1953 г. опубликовали статьи с описанием больных хроническими гематологическими заболеваниями, сопровождающимися анемией, с исходом в острый миелоидный лейкоз (ОМЛ).
Этим нарушениям кроветворения было дано определение «предлейкемия». В 1956 г. S. E. Bjorkman описал развитие острого лейкоза больных хронической рефрактерной анемией с наличием в костном мозге кольцевых сидеробластов.

Первый обзор литературы, обобщающий данные о предлейкемии по результатам наблюдений 143 больных, был опубликован М. I. Saarni и J. W. Linman в 1973 г.. (Из анализа были исключены заболевания, сопровождающиеся дисплазией кроветворения, такие как синдром Дауна, иммунодефицитные состояния, а также случаи, связанные с воздействием ионизирующего излучения).
Исследователи детально описали наиболее характерные качественные и количественные изменения крови и костного мозга этих пациентов, клинические признаки и причины смерти. Полученные данные позволили предположить наличие у больных самостоятельного заболевания, которое предшествует развитию ОМЛ.
В 1976 г. международной группой французских, американских и британских исследователей (ФАБ-группа) наряду с острыми лимфобластными (ОЛЛ) и острыми миелоидными лейкозами (ОМЛ) в отдельную группу были выделены дисмиелопоэтические синдромы, представленные рефрактерной анемией с избытком бластов и хроническим миеломоноцитарным лейкозом.
Термин «миелодиспластические синдромы» был предложен ФАБ-группой в 1982 г.. Тогда же была создана классификация МДС, которая после внесения уточнений продолжает широко использоваться и в настоящее время. Она включает 5 вариантов заболевания:
1) рефрактерная анемия (РА);
2) рефрактерная анемия с кольцевыми сидеробластами (РАКС);
3) рефрактерная анемия с избытком бластов (РАИБ);
4) рефрактерная анемия с избытком бластов в стадии трансформации в острый лейкоз (РАИБ-Т);
5) хронический миеломоноцитарный лейкоз (ХМ МЛ).
За последнюю четверть XX в. с внедрением новых методов исследования произошли существенные изменения в понимании биологии МДС, что нашло отражение в совершенствовании классификации. В 1997 г. Всемирная организация здравоохранения (ВОЗ) предложила внести поправки в ФАБ-классификацию, которые были приняты и опубликованы в 2001 г.. Согласно классификации ВОЗ, выделяют 8 вариантов миелодиспластических синдромов, которые будут рассмотрены ниже.
Как самостоятельная нозологическая форма миелодиспластические синдромы были включены в 1992 г. в Международную классификацию болезней десятого пересмотра (МКБ-10) в раздел «Новообразования неопределенного или неизвестного характера».
— Также рекомендуем «Эпидемиология миелодиспластических синдромов (МДС) — заболеваемость»
Оглавление темы «Онкогематология»:
- Преодоление лекарственной устойчивости при остром лейкозе — моноклональная антитела
- Новые методы трансплантации костного мозга в лечении острого лейкоза
- Программы химиотерапии острых лимфобластных лейкозов — схемы
- Программы химиотерапии острых миелоидных лейкозов — схемы
- Программы химиотерапии острых промиелоцитарных лейкозов — схемы
- Что такое миелодиспластический синдром (МДС)? — история изучения
- Эпидемиология миелодиспластических синдромов (МДС) — заболеваемость
- Клональность миелодиспластических синдромов (МДС) — клональная теория
- Этиология миелодиспластических синдромов (МДС) — причины
- Мутации генов при миелодиспластических синдромах
Источник
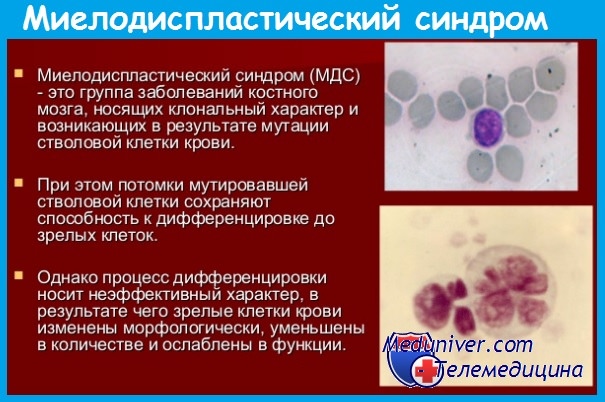
Миелодиспластический синдром – группа гематологических заболеваний, при которых наблюдаются цитопения, диспластические изменения костного мозга и высокий риск возникновения острого лейкоза. Характерные симптомы отсутствуют, выявляются признаки анемии, нейтропении и тромбоцитопении. Диагноз устанавливается с учетом данных лабораторных анализов: полного анализа периферической крови, гистологического и цитологического исследования биоптата и аспирата костного мозга и т. д. Дифференциальный диагноз может представлять значительные затруднения. Лечение – переливание компонентов крови, химиотерапия, иммуносупрессивная терапия, пересадка костного мозга.
Миелодиспластический синдром
Миелодиспластический синдром – группа заболеваний и состояний с нарушениями миелоидного кроветворения и высоким риском развития острого лейкоза. Вероятность развития увеличивается с возрастом, в 80% случаев данный синдром диагностируется у людей старше 60 лет. Мужчины страдают несколько чаще женщин. У детей миелодиспластический синдром практически не встречается. В последние десятилетия гематологи отмечают увеличение заболеваемости среди лиц трудоспособного возраста. Предполагается, что причиной «омоложения» болезни могло стать существенное ухудшение экологической обстановки.
До недавнего времени лечение миелодиспластического синдрома было только симптоматическим. Сегодня специалисты разрабатывают новые методы терапии, однако эффективное лечение этой группы болезней все еще остается одной из самых сложных проблем современной гематологии. Пока прогноз при миелодиспластическом синдроме, в основном, зависит от особенностей течения болезни, наличия или отсутствия осложнений. Лечение осуществляют специалисты в сфере онкологии и гематологии.
Причины и классификация миелодиспластического синдрома
С учетом причин развития различают два типа миелодиспластического синдрома: первичный (идиопатический) и вторичный. Идиопатический вариант выявляется в 80-90% случаев, диагностируется преимущественно у пациентов старше 60 лет. Причины возникновения установить не удается. В числе факторов риска первичного миелодиспластического синдрома – курение, повышенный уровень радиации при выполнении профессиональных обязанностей или проживании в неблагоприятной экологической зоне, частый контакт с бензином, пестицидами и органическими растворителям, некоторые наследственные и врожденные заболевания (нейрофиброматоз, анемия Фанкони, синдром Дауна).
Вторичный вариант миелодиспластического синдрома наблюдается в 10-20% случаев, может возникать в любом возрасте. Причиной развития становится химиотерапия или радиотерапия по поводу какого-то онкологического заболевания. В число лекарственных средств с доказанной способностью вызывать миелодиспластический синдром включают циклофосфан, подофиллотоксины, антрациклины (доксорубицин) и ингибиторы топоизомеразы (иринотекан, топотекан). Вторичный вариант отличается более высокой резистентностью к лечению, более высоким риском развития острого лейкоза и более неблагоприятным прогнозом.
В современной редакции классификации ВОЗ различают следующие типы миелодиспластического синдрома:
- Рефрактерная анемия. Сохраняется более полугода. В анализе крови бласты отсутствуют либо единичные. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная анемия с кольцевыми сидеробластами. Сохраняется более полугода. В анализе крови бласты отсутствуют. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная цитопения с многолинейной дисплазией. В анализе крови тельца Ауэра отсутствуют, бласты отсутствуют либо единичные, выявляются панцитопения и увеличение количества моноцитов. В костном мозге диспластические изменения менее 10% клеток в 1 миелоидной клеточной линии, бластов менее 5%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-1. В анализе крови тельца Ауэра отсутствуют, бластов более 5%, цитопения и увеличение количества моноцитов. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 5-9%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-2. В анализе крови увеличение количества моноцитов, цитопения, бластов 5-19%, могут выявляться тельца Ауэра. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 10-19%, обнаруживаются тельца Ауэра.
- Неклассифицируемый миелодиспластический синдром. В анализе крови цитопения, бласты отсутствуют либо единичные, тельца Ауэра отсутствуют. В костном мозге дисплазия одного мегакариоцитарного либо гранулоцитарного ростка, бластов более 5%, тельца Ауэра отсутствуют.
- Миелодиспластический синдром, ассоциированный с изолированной делецией 5q. В анализе крови анемия, бластов более 5%, возможен тромбоцитоз. В костном мозге более 5% бластов, тельца Ауэра отсутствуют, изолированная делеция 5q.
Симптомы миелодиспластического синдрома
Клиническая симптоматика определяется степенью нарушений миелопоэза. При мягко протекающих расстройствах возможно длительное бессимптомное или стертое течение. Из-за слабой выраженности клинических проявлений некоторые больные не обращаются к врачам, и миелодиспластический синдром обнаруживается во время проведения очередного медицинского осмотра. При преобладании анемии наблюдаются слабость, одышка, плохая переносимость физических нагрузок, бледность кожных покровов, головокружения и обморочные состояния.
При миелодиспластическом синдроме с тромбоцитопенией возникает повышенная кровоточивость, отмечаются десневые и носовые кровотечения, на коже появляются петехии. Возможны подкожные кровоизлияния и меноррагии. Миелодиспластический синдром с выраженными нейтропенией и агранулоцитозом проявляется частыми простудами, стоматитом, синуситом или стрептодермией. В тяжелых случаях возможно развитие пневмонии или сепсиса. Инфекционные заболевания нередко вызываются грибками, вирусами или условно-патогенными микробами. У каждого пятого пациента с миелодиспластическим синдромом выявляется увеличение лимфоузлов, селезенки и печени.
Диагностика миелодиспластического синдрома
Диагноз выставляется с учетом данных лабораторных исследований: анализа периферической крови, биопсии костного мозга с последующим цитологическим исследованием, цитохимических и цитогенетических тестов. В анализе периферической крови больных миелодиспластическим синдромом обычно обнаруживается панцитопения, реже выявляется дву- или одноростковая цитопения. У 90% пациентов наблюдается нормоцитарная либо макроцитарная анемия, у 60% — нейтропения и лейкопения. У большинства больных миелодиспластическим синдромом отмечается тромбоцитопения.
При исследовании костного мозга количество клеток обычно нормальное либо повышенное. Уже на ранних стадиях обнаруживаются признаки дизэритропоэза. Количество бластов зависит от формы миелодиспластического синдрома, может быть нормальным либо увеличенным. В последующем наблюдаются дисгранулоцитопоэз и дисмегакариоцитопоэз. У некоторых больных признаки дисплазии костного мозга выражены очень слабо. В процессе цитогенетического исследования у ¾ больных выявляются хромосомные нарушения. Дифференциальный диагноз миелодиспластического синдрома проводят с В12-дефицитной анемией, фолиево-дефицитной анемией, апластической анемией, острым миелолейкозом и другими острыми лейкозами.
Лечение и прогноз при миелодиспластическом синдроме
Тактика лечения определяется выраженностью клинической симптоматики и лабораторных изменений. При отсутствии явных признаков анемии, геморрагического синдрома и инфекционных осложнений осуществляется наблюдение. При миелодиспластическом синдроме с выраженной анемией, тромбоцитопенией и нейтропенией, а также при высоком риске возникновения острого лейкоза назначают сопроводительную терапию, химиотерапию и иммуносупрессивную терапию. При необходимости осуществляют пересадку костного мозга.
Сопроводительная терапия является самым распространенным методом лечения миелодиспластического синдрома. Предусматривает внутривенные инфузии компонентов крови. При длительном применении может провоцировать повышение уровня железа, влекущее за собой нарушения деятельности жизненно важных органов, поэтому переливания гемокомпонентов производят при одновременном приеме хелаторов (лекарственных средств, связывающих железо и способствующих его выведению).
Иммуносупрессоры эффективны при лечении миелодиспластического синдрома с отсутствием хромосомных аномалий, наличием гена HLA-DR15 и гипоклеточном костном мозге. Химиотерапию применяют при невозможности трансплантации костного мозга. Высокие дозы препаратов используют при трансформации миелодиспластического синдрома в острый лейкоз, а также при рефрактерных анемиях с избытком бластов при нормоклеточном и гиперклеточном костном мозге, низкие – при невозможности пересадки костного мозга. Наряду с перечисленными средствами пациентам назначают гипометилирующие средства (азацитидин). Наиболее надежным способом достижения полноценной длительной ремиссии является трансплантация костного мозга.
Прогноз зависит от типа миелодиспластического синдрома, количества хромосомных аномалий, необходимости в регулярных переливаниях компонентов крови, выраженности клинических проявлений и наличия осложнений. Различают 5 групп риска. Средняя выживаемость больных миелодиспластическим синдромом, входящих в группу с самым низким уровнем риска, составляет более 11 лет; с самым высоким – около 8 месяцев. Вероятность отторжения костного мозга после трансплантации – около 10%.
Источник
