Наследственные болезни обмена болезни соединительной ткани
Наследственные болезни соединительной ткани относятся к наиболее распространенным генетическим синдромам. К ним относят чаще всего несовершенный остеогенез, синдромы Элерса—Данло и Марфана.
Классификация этих синдромов основывается обычно на результатах работы McKusick, который проанализировал признаки, симптомы и морфологические изменения у большого числа больных. Однако классификация осложняется гетерогенностью этих синдромов. У больных, членов некоторых семей, отсутствует, например, один или несколько кардинальных признаков. В других семьях выявляют больных с двумя или тремя разными синдромами. Гетерогенность может быть обнаружена и среди членов одной семьи. Например, у одних больных в семье определяется дислокация суставов, характерная для синдрома Элерса—Данло, у других — хрупкость костей, типичная для несовершенного остеогенеза, а у третьих с тем же генным дефектом симптомы вообще отсутствуют. Из-за этих трудностей классификация, основанная на клинических данных, в конце концов, должна будет смениться классификацией, основанной на результатах анализа молекулярных дефектов в отдельных генах.
Организация и химический состав соединительной ткани. Соединительная ткань (или ткани) имеет довольно расплывчатое определение: внеклеточные компоненты, служащие опорой и связывающие воедино клетки, органы и ткани. К соединительным тканям относятся в основном кости, кожа, сухожилия, связки и хрящи. Они включают в себя такие кровеносные сосуды и синовиальные пространства и жидкости. На самом деле, соединительная ткань входит в состав всех органов и тканей в виде мембран и перегородок.
Соединительные ткани содержат большие количества жидкости в виде фильтрата крови, в котором находится почти половина всего альбумина организма. Большинство соединительных тканей заполнены или окружены фибриллами или волокнами коллагена (табл. 319-1) и содержат протеогликаны.
Различия соединительных тканей до некоторой степени обусловлены незначительной вариабельностью размеров и ориентации коллагеновых фибрилл. В сухожилиях они собраны в толстые параллельные пучки, в коже расположены менее упорядочение. В костях фибриллы строго организуются вокруг гаверсовых каналов, ригидность этой архитектуре придает гидроксиапатит. Основной коллаген сухожилий, кожи и костей (коллаген I типа) состоит из двух полипептидных цепей, продуктов разных структурных генов. Различия между перечисленными тканями в большой мере связаны с разной экспрессией структурных генов коллагена I типа, т. е. с разными количеством синтезируемого коллагена, толщиной и длиной образующихся фибрилл и их расположением.
Некоторые различия между соединительными тканями обусловлены присутствием ткане- или органоспецифических генных продуктов. Кости содержат белки, играющие важнейшую роль в минерализации коллагена, аорта — эластин и сопутствующий микрофибриллярный белок, несколько типов коллагена и другие компоненты. Базальная мембрана, лежащая под всеми эпителиальными и эндотелиальными клетками, содержит коллаген IV типа и другие тканеспецифические макромолекулы, а кожа и некоторые другие соединительные ткани—небольшие количества особых видов коллагена.
Таблица 319-1. Состав соединительной ткани в разных органах
| Орган | Известные компоненты | Примерное количество, % сухой массы | Свойства |
| Кожа (дерма), связки, сухожилия | Коллаген I типа | Пучки волокон с высоким пределом прочности при растяжении | |
| Коллаген III типа | 5—15 | Тонкие фибриллы | |
| Коллаген IV типа, ламинин, энтактин, нидоген | Менее 5 | В базальной мембране под эпителием и в кровеносных сосудах | |
| Коллаген V—VII типов | Менее 5 | Распределение и функции неясны | |
| Фибронектин | Менее 5 | Связан с коллагеновыми волокнами и клеточной поверхностью | |
| Протеогликаны’ | 0,5 | Обеспечивают упругость | |
| Гиалуронат | 0,5 | Обеспечивает упругость | |
| Кость (демине-рализован-ная) | Коллаген’1 типа | Сложная организация фибрилл | |
| Коллаген V типа | 1—2 | Функция неясна | |
| Протеогликаны | » » | ||
| Сиалопротеины | » » | ||
| Остеонектин | 2—3 | Роль в оссификации | |
| Остеокальцин | Возможная роль в оссификации | ||
| а 2-Гликопроте ин | То же | ||
| Аорта | Коллаген I типа | 20—40 | |
| Коллаген III типа | 20—40 | Тонкие фибриллы | |
| Эластин, микрофибриллярный белок | 20—40 | Аморфное вещество, эластические фибриллы | |
| Коллаген IV типа, лами | Менее 5 | В базальной мембране | |
| нин, энтактин, нидоген | | | |
| Коллаген V и VI типов | Менее 2 | Функция неясна | |
| Протеогликаны | Менее 3 | Мукополисахариды, в основном хондроитинсульфат и дерматан-сульфат; гепарансульфат в базальной мембране | |
| Хрящ | Коллаген II типа | 40—50 | Тонкие фибриллы |
| Коллаген IX и Х типов | 5—25 | Возможная роль в созревании | |
| Протеогликаны | 15—20 | Обеспечивают упругость | |
| Гиалуронат | 0,5—2 | Обеспечивает упругость |
‘ Протеогликановые структуры изучены недостаточно. Установлено примерно пять белковых ядер, и к каждому присоединен один вид мукополисахаридов или несколько. К основным мукополисахаридам кожи и сухожилий относятся дерматансульфат и хондроитин-4-сульфат, аорты — хондроитин-4-сульфат и дерматан-сульфат, хряща — хондроитин-4-сульфат, хондроитин-6-сульфат и кератансульфат. Базальная мембрана содержит гепарансульфат.
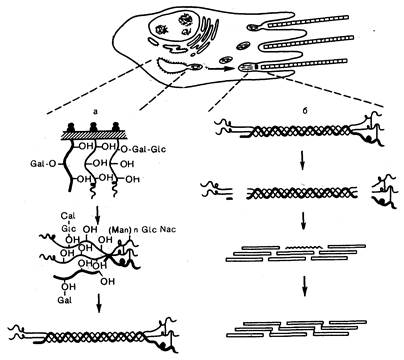
Биосинтез соединительной ткани. Синтез соединительных тканей заключается в самосборке из молекулярных субъединиц с точными размерами, формой и поверхностными свойствами. Молекула коллагена представляет собой длинный тонкий стержень, состоящий из трех а-полипептидных цепей, скрученных в жесткую, похожую на канат структуру (рис. 319-1). Каждая -цепь состоит из простых повторяющихся аминокислотных последовательностей, в которых каждый третий остаток представлен глицином (Гли). Поскольку каждая -цепь содержит около 1000 аминокислотных остатков, ее аминокислотную последовательность можно обозначить как (-Гли-Х-У-)ззз, где Х и Y — любые аминокислоты, кроме глицина. Тот факт, что каждый третий остаток — это глицин (самая малая аминокислота), весьма важен, так как он должен входить в стерически ограниченное пространство, в котором сходятся все три нити тройной спирали. Две -цепи в коллагене I типа одинаковы и называются 1(1). Третья же имеет несколько другую аминокислотную последовательность и называется 2(1). Некоторые типы коллагена состоят из трех одинаковых -цепей. Те участки -цепей, в которых на месте Х находится пролин или на месте Y — гидроксипролин, придают жесткость всей молекуле коллагена и удерживают ее в форме тройной спирали. Гидрофобные и заряженные аминокислоты в положениях Х и Y имеют вид кластеров на поверхности молекулы и определяют способ, которым одна молекула коллагена спонтанно связывается с другими, образуя цилиндрические фигуры, характерные для каждой коллагеновой фибриллы (см. рис. 319-1).

Рис.319-1. Схематическое изображение синтеза фибриллы коллагена I типа в фибробласте.
Внутриклеточные этапы сборки молекулы проколлагена (а): гидроксилирование и гликозилирование про-а-цепей начинается вскоре после того, как их N-концы проникнут в цистерны шероховатой эндоплазматической сети, и продолжается после сближения С-пропептидов трех цепей и образования между ними дисульфидных связей. Расщепление проколлагена с образованием коллагена, самосборка коллагеновых молекул в свободно прилегающие друг к другу нити и перекрестное связывание их в фибриллы (б): отщепление пропептидов может происходить в криптах фибробласта или в некотором отдалении от клетки (воспроизведено с разрешения из Prockop and Kivinkko).
Если структура и функция молекулы коллагена достаточно просты, то ее синтез весьма сложен (см. рис. 319-1). Белок синтезируется в виде предшественника, называемого проколлагеном, масса которого примерно в 1,5 раза больше массы молекулы коллагена. Эта разница обусловлена присутствием в проколлагене дополнительных аминокислотных последовательностей как на N-, так и на С-конце. Для образования нитей коллагена необходимо действие специфической N-протеиназы, отщепляющей N-концевые пропептиды, и специфической С-протеиназы, отщепляющей С-концевые пропептиды. По мере сборки про--цепей коллагена на рибосомах эти цепи проникают в цистерны шероховатой эндоплазматической сети. Гидрофобные «сигнальные пептиды» на N-концах отщепляются, и начинается ряд дополнительных посттрансляционных реакций. Остатки пролина в позиции Y под действием специфической гидроксилазы, требующей аскорбиновой кислоты, превращаются в оксипролин. Другая гидроксилаза в присутствии аскорбиновой кислоты точно так же гидроксилирует остатки лизина в позиции Y. Необходимость аскорбиновой кислоты для действия обеих гидроксилаз, вероятно, объясняет, почему при цинге не заживают раны (см. гл. 76). Многие гидроксилизиновые остатки подвергаются дальнейшей модификации, гликолизируясь галактозой или галактозой и глюкозой. К С-концевым пропептидам каждой цепи присоединяется крупный, богатый маннозой олигосахарид. С-концевые пропептиды сближаются, и между ними образуются дисульфидные связи. Когда в каждой про--цепй окажется примерно 100 гидропролиновых остатков, белок спонтанно сворачивается, приобретая конформацию тройной спирали. Свернувшись, белок под действием N- и С-протеиназ превращается в коллаген.
Фибриллы, образованные путем самосборки коллагеновой молекулы, обладают высоким пределом прочности при растяжении, и эта прочность еще более увеличивается за счет перекрестных реакций с образованием ковалентных связей между -цепями соседних молекул. Первый этап перекрестного связывания — окисление ферментом лизиноксидазой аминогрупп в остатках лизина и гидроксилизина с образованием альдегидов; последние затем и формируют прочные ковалентные связи друг с другом.
Коллагеновые фибриллы и волокна во всех тканях, кроме костной, стабильны на протяжении почти всей жизни и распадаются только при голодании или истощении тканей. Однако фибробласты, синовиальные и другие клетки способны продуцировать коллагеназы, расщепляющие коллагеновую молекулу в точке, отстоящей от N-конца примерно на 3/4 длины молекулы, и тем самым запускают дальнейшее разрушение коллагеновых фибрилл и волокон другими протеиназами. В костях же непрерывно происходят разрушение и ресинтез коллагеновых фибрилл, что служит необходимым условием перестройки кости. Таким образом, для сборки и сохранения коллагеновых фибрилл в тканях требуется координированная экспрессия ряда генов, продукты которых необходимы для посттрансляционного формирования этих фибрилл или участвуют в метаболизме коллагена.
Сборка фибрилл коллагена I типа аналогична сборке фибрилл коллагена II типа в хряще и коллагена III типа в аорте и коже. При формировании же нефибриллярных коллагенов, таких как тип IV в базальных мембранах, не происходит отщепления глобулярных доменов на концах молекул. Сохраняясь, эти домены участвуют в самосборке мономеров в плотные сети. Волокна эластина компонуются тем же путем. Однако эластиновый мономер представляет собой одну полипептидную цепь без четкой трехмерной структуры, самообразующую аморфные эластические волокна.
Синтез протеогликанов сходен с синтезом коллагена в том отношении, что он начинается со сборки полипептидной цепи, называемой белковым ядром. В цистернах шероховатой эндоплазматической сети белковое ядро модифицируется путем присоединения остатков Сахаров и сульфата, которые образуют крупные мукополисахаридные боковые цепи. После секреции во внеклеточное пространство белковое ядро с его мукополисахаридными боковыми цепями связывается с соединяющим белком, а затем с длинноцепочечной гиалуроновой кислотой, образуя зрелый протеогликан с относительной молекулярной массой в несколько миллионов.
Построение кости следует тем же самым принципам, что и сборка других соединительных тканей (см. также гл. 335). Первый этап заключается в отложении остеоидной ткани, которая состоит в основном из коллагена I типа (см. рис. 319-1). Далее, «еще не до конца выясненным путем происходит минерализация остеоидной ткани; особые белки, такие как остеонектин, связываются со специфическими участками коллагеновых фибрилл и затем хелируют кальций, начиная минерализацию.
Значение для наследственных болезней. Наше знание химии и биохимии соединительных тканей недостаточно полно, но тем не менее позволяет понять некоторые клинические особенности наследственных болезней этих тканей. Например, понятно, почему многие из этих болезней имеют системные проявления. Поскольку весь коллаген I типа синтезируется на одних и тех же двух структурных генах, любая мутация этих генов должна экспрессироваться во всех тканях, содержащих коллаген I типа. Тканевая или органная специфичность болезни может быть объяснена двояко. Один из механизмов может заключаться в том, что болезнь вызывается мутацией гена, экспрессирующегося только в одной или двух соединительных тканях. Например, у больных с синдромом Элерса — Данло IV типа имеются мутации генов проколлагена III типа, и его проявления ограничены изменениями кожи, аорты и кишечника, т. е. тканей, богатых коллагеном III типа. Вторая причина тканевой специфичности болезней более тонка. Разные участки молекул коллагена выполняют разные биологические функции. Так, если речь идет о коллагене I типа, то отщепление N-концевых пропептидов необходимо для сборки крупных коллагеновых фибрилл и волокон в связках и сухожилиях. При неполном отщеплении N-пропептидов белок образует тонкие фибриллы. Следовательно, больные с такими мутациями генов проколлагена I типа, препятствующих эффективному отщеплению N-пропептидов, должны страдать преимущественно дислокацией бедренных и других крупных суставов. У них редко бывают переломы, поскольку формирование толстых фибрилл коллагена I типа, по-видимому, менее важно для нормальной функции костей, чем для нормальной функции суставных связок. Наоборот, у больных с мутациями, затрагивающими структуру других участков молекулы проколлагена I типа, может преобладать костная патология.
Современные данные о химии матрикса позволяют понять причины гетерогенности симптоматики и у больных с одинаковыми генными дефектами. Экспрессия гена коллагена или протеогликана зависит от координированной экспрессии генов ферментов, принимающих участие в посттрансляционной модификации этих соединений, а также от экспрессии генов других компонентов того же матрикса. В связи с этим конечное влияние этой мутации на функциональные свойства такой сложной структуры, как кость или крупный кровеносный сосуд, зависит от различий в «генетическом фоне» разных лиц, а именно от различий в экспрессии .большого семейства других генов, продукты которых влияют на ту же структуру. Клинические проявления болезни должны зависеть и от других факторов, влияющих на соединительную ткань, таких как физическая нагрузка, травмы, питание и гормональные аномалии. Следовательно, имеется широкая основа для вариабельности клинических проявлений у больных с одним и тем же дефектом.
Выявление молекулярных дефектов. Для того чтобы выявить молекулярный дефект у больного с наследственной болезнью соединительной ткани, требуются большие усилия (рис. 319-2). Одна из причин этого заключается в том, что у двух не состоящих в родственной связи больных, даже с идентичными клиническими симптомами, молекулярные дефекты различны. Вторая причина сводится к тому, что белки и протеогликаны соединительной ткани представляют собой крупные молекулы, которые трудно перевести в раствор и получить в чистом виде. Кроме того, у больных дефект определяет синтез аномального, быстро распадающегося белка. В связи с этим при анализе тканей трудно установить, какой именно генный продукт аномален. Третья причина — большие размеры генов компонентов матрикса. В случае проколлагена I типа ген про-al (1)-цепи состоит из 18 000 пар оснований, а ген про-а2(1)-цепи— из 38000 пар. Каждый из этих генов имеет примерно 50 экзонов, большинство которых сходны по структуре. С помощью доступной в настоящее время техники рекомбинантной ДНК выяснение места мутации одного или нескольких оснований — задача неимоверной трудности. Однако новые методы позволяют, вероятно, преодолеть большинство этих проблем.
Источник
Ñòðóêòóðà è ôóíêöèè ñîåäèíèòåëüíîé òêàíè. Âîïðîñû òåðìèíîëîãèè è êëàññèôèêàöèè äèñïëàçèè ñîåäèíèòåëüíîé òêàíè. Íåäèôôåðåíöèðîâàííûå äèñïëàçèè ñîåäèíèòåëüíîé òêàíè. Êðèòåðèè äèàãíîçà ãèïåðìîáèëüíîãî ñèíäðîìà. Ñèíäðîì Ýëåðñà-Äàíëî è ñèíäðîì Ìàðôàíà.
Ñòóäåíòû, àñïèðàíòû, ìîëîäûå ó÷åíûå, èñïîëüçóþùèå áàçó çíàíèé â ñâîåé ó÷åáå è ðàáîòå, áóäóò âàì î÷åíü áëàãîäàðíû.
E. Âðîæäåííûå ïîðîêè ñåðäöà
36.Ïîêàçàíèÿìè äëÿ òîðàêîïëàñòèêè ó äåòåé ñ ñèíäðîìîì Ìàðôàíà ÿâëÿþòñÿ:
A. Âîðîíêîîáðàçíàÿ äåôîðìàöèÿ ãðóäíîé êëåòêè II-III ñòåïåíè
B. ×àñòûå îñòðûå ðåñïèðàòîðíûå çàáîëåâàíèÿ
C. Ïåðåãðóçêà ëåâûõ îòäåëîâ ñåðäöà
D. Âîçðàñò äî 4-õ ëåò
37.Ïðåïàðàòàìè âûáîðà äëÿ ïðîôèëàêòèêè äèëàòàöèè è ðàññëîåíèÿ àîðòû ÿâëÿþòñÿ:
A. Áåòà-áëîêàòîðû
B. Âèòàìèíû
C. Ïðåïàðàòû L-êàðíèòèíà
D. Áëîêàòîðû êàëüöèåâûõ êàíàëîâ
38.Ôàêòîðàìè ðèñêà ðàññëîåíèÿ àîðòû ïðè ñèíäðîìå Ìàðôàíà ÿâëÿþòñÿ:
A. Âîðîíêîîáðàçíàÿ äåôîðìàöèÿ ãðóäíîé êëåòêè II-III ñòåïåíè
B. Äèàìåòð àîðòû >5 ñì, ðàñïðîñòðàíåíèå äèëàòàöèè çà ïðåäåëû ñèíóñà Âàëüñàëüâû, áûñòðî ïðîãðåññèðóþùàÿ äèëàòàöèÿ (> 5% èëè 2 ìì â ãîä, ó âçðîñëûõ) ñåìåéíûå ñëó÷àè ðàññëîåíèÿ àîðòû
C. Äèàìåòð àîðòû ? 5 ñì, ïðîãðåññèðóþùàÿ äèëàòàöèÿ > 5% â ãîä, ó âçðîñëûõ, ñåìåéíûå ñëó÷àè ðàññëîåíèÿ àîðòû
D. Ïåðåãðóçêà ëåâûõ îòäåëîâ ñåðäöà
E. Âîçðàñò äî 4-õ ëåò
39.Êàê ÷àñòî, ó äåòåé ñ ñèíäðîìîì Ìàðôàíà, ðåêîìåíäóåòñÿ ïðîâîäèòü ÝÕÎ-ÊÃ:
A. Îäèí ðàç â 6-12 ìåñÿöåâ
B. Îäèí ðàç â ìåñÿö
C. Îäèí ðàç â 3 ãîäà
D. Îäèí ðàç â êâàðòàë
Ðàçäåë ²Y -Â ÍÅÑÎÂÅÐØÅÍÍÛÉ ÎÑÒÅÎÃÅÍÅÇ
Íåñîâåðøåííûé îñòåîãåíåç (áîëåçíü Ëîáøòåéíà) — íàñëåäñòâåííîå çàáîëåâàíèå, õàðàêòåðèçóþùååñÿ ãåíåðàëèçîâàííûì äåôèöèòîì êîñòíîé ìàññû (îñòåîïåíèÿ) è ÷ðåçâû÷àéíî âûðàæåííîé õðóïêîñòüþ, ëîìêîñòüþ êîñòåé. Ïðèáëèçèòåëüíî ó 95% áîëüíûõ èìåþòñÿ ìóòàöèè ãåíîâ, êîäèðóþùèõ ñèíòåç ïðî-à, è ïðî-à2 ïåïòèäîâ êîëëàãåíà 1-ãî òèïà.
×àñòîòà çàáîëåâàíèÿ ðàçëè÷íà â çàâèñèìîñòè îò òèïà. ² òèï íåñîâåðøåííîãî îñòåîãåíåçà âñòðå÷àåòñÿ ñ ÷àñòîòîé 1 íà 30 000, II òèï — ñ ÷àñòîòîé 1 íà 60 000, III è IV òèïû — ñ ÷àñòîòîé 1 íà 20 000 ÷åëîâåê.
Íàèáîëåå ïðèçíàííîé êëàññèôèêàöèåé íåñîâåðøåííîãî îñòåîãåíåçà ÿâëÿåòñÿ êëàññèôèêàöèÿ, ïðåäëîæåííàÿ Sillence. Âûäåëÿþò 4 òèïà çàáîëåâàíèÿ â çàâèñèìîñòè îò êëèíè÷åñêèõ ïðîÿâëåíèé è òèïà íàñëåäîâàíèÿ.
Êëàññèôèêàöèÿ íåñîâåðøåííîãî îñòåîãåíåçà (ïî Sillence)
Òèï | Ëîìêîñòü êîñòåé | Ãîëóáûå ñêëåðû | Àíîìàëèè çóáîâ | Ãëóõîòà | Òèï íàñëåäîâàíèÿ |
I | Ëåãêàÿ ñòåïåíü | Îïðåäåëÿþòñÿ | Îòñóòñòâóþò ïðè ïîäòèïå ² À, èìåþòñÿ ïðè ïîäòèïå ² Á | Èìååòñÿ ó áîëüøèíñòâà áîëüíûõ | Àóòîñîìíî- äîìèíàíòíûé |
II | Ðåçêî âûðàæåííàÿ | Îïðåäåëÿþòñÿ | Èìåþòñÿ â íåêîòîðûõ ñëó÷àÿõ | Îòñóòñòâóåò | Ñïîðàäè÷åñêèé, ðåæå — àóòîñîìíî- ðåöåññèâíûé |
III | Âûðàæåííàÿ | Ãîëóáîé öâåò ñêëåð ïðè ðîæäåíèè | Èìåþòñÿ â íåêîòîðûõ ñëó÷àÿõ | Âñòðå÷àåòñÿ î÷åíü ÷àñòî | Àóòîñîìíî- ðåöåññèâíûé |
IV | Âàðèàáåëüíûé ïðèçíàê | Íå îïðåäå- ëÿþòñÿ | Îòñóòñòâóþò ïðè ²VÀ ïîäòèïå âûÿâëÿþòñÿ Ïðè ²VÁ ïîäòèïå | Âñòðå÷àåòñÿ î÷åíü ÷àñòî | Àóòîñîìíî- äîìèíàíòíûé |
Êëèíè÷åñêàÿ êàðòèíà
Àíîìàëèè ñêåëåòà. Ïîðàæåíèå êîñòåé íàáëþäàåòñÿ ïðè âñåõ òèïàõ áîëåçíè, íî íàèáîëåå âûðàæåíû ïðè II è ²II òèïàõ. Îáðàùàåò âíèìàíèå, ëîìêîñòü è õðóïêîñòü êîñòåé, ìíîæåñòâåííûå, ÷àñòî ïîâòîðÿþùèåñÿ, ïåðåëîìû ðàçëè÷íîé ëîêàëèçàöèè. Ïåðåëîìû âîçíèêàþò ïîä âëèÿíèåì ìèíèìàëüíûõ ôèçè÷åñêèõ âîçäåéñòâèé, è ðàçâèâàþòñÿ óæå â ðàííåì äåòñêîì âîçðàñòå, èíîãäà åùå âî âíóòðèóòðîáíîì ïåðèîäå èëè â ïåðèîäå íîâîðîæäåííîñòè. Ïîñëå îêîí÷àíèÿ ïóáåðòàòíîãî ïåðèîäà ÷àñòîòà ïåðåëîìîâ íåñêîëüêî óìåíüøàåòñÿ. Ïåðåëîìû êîñòåé, ìîãóò ïðèâåñòè ê íèçêîðîñëîñòè, ðàçëè÷íûì êîñòíûì äåôîðìàöèÿì, êèôîñêîëèîçó.  ñâîþ î÷åðåäü, ðåçêî âûðàæåííûå êèôîñêîëèîç è äåôîðìàöèè ãðóäíîé êëåòêè ñïîñîáñòâóþò íàðóøåíèþ äûõàíèÿ è ðàçâèòèþ ëåãî÷íîé ãèïåðòåíçèè è õðîíè÷åñêîãî ëåãî÷íîãî ñåðäöà. Ïðè ðåíòãåíîëîãè÷åñêîì èññëåäîâàíèè êîñòåé è ïîçâîíêîâ îïðåäåëÿåòñÿ îñòåîïîðîç (îñòåîïåíèÿ). Õàðàêòåðåí ãèïåðîñòîç çàòûëî÷íîé êîñòè.
Íåñîâåðøåííûé äåíòèíîãåíåç. Ïðîÿâëÿåòñÿ êëèíè÷åñêè òåì, ÷òî ìîëî÷íûå çóáû îáû÷íî ìåëü÷å, ÷åì â íîðìå, à ïîñòîÿííûå — ïðèîáðåòàþò îñòðóþ ôîðìó. Èç-çà íåïðàâèëüíîãî îòëîæåíèÿ äåíòèíà çóáû ìîãóò èìåòü æåëòîâàòûé, æåëòîâàòî-êîðè÷íåâûé èëè ãîëóáîâàòî-ñåðûé öâåò.
Ãëóõîòà. Ïîòåðÿ ñëóõà îáû÷íî íà÷èíàåòñÿ âî âòîðîé äåêàäå æèçíè è â âîçðàñòå ñòàðøå 30 ëåò íàáëþäàåòñÿ ó 90% áîëüíûõ. Ãëóõîòà ìîæåò áûòü êîíäóêòèâíîé (âñëåäñòâèå íàðóøåíèÿ ïðîõîæäåíèÿ çâóêîâûõ êîëåáàíèé ÷åðåç ñðåäíåå óõî íà óðîâíå íåäîñòàòî÷íî îññèôèöèðîâàííîãî ñòðåìåíè), íåéðîñåíñîðíîé èëè ñìåøàííîé.
Äðóãèå êëèíè÷åñêèå ïðîÿâëåíèé. ×àñòî ó ìíîãèõ áîëüíûõ íàðÿäó ñ ïîðàæåíèåì êîñòåé îáíàðóæèâàþòñÿ àíîìàëèè è äðóãèõ âèäîâ ñîåäèíèòåëüíîé òêàíè. Ìîãóò íàáëþäàòüñÿ èñòîí÷åíèå, ðàñòÿæèìîñòü è ëåãêàÿ ðàíèìîñòü êîæè, êàê ïðè ñèíäðîìå Ýëåðñà-Äàíëî, ãèïåðìîáèëüíîñòü ñóñòàâîâ. Ó íåêîòîðûõ áîëüíûõ âûÿâëÿþòñÿ ïîðîêè ñåðäöà (ìèòðàëüíàÿ íåäîñòàòî÷íîñòü, ðåæå — íåäîñòàòî÷íîñòü êëàïàíà àîðòû).
Ó 25% áîëüíûõ èìåþòñÿ ïðîÿâëåíèÿ ãåìîððàãè÷åñêîãî äèàòåçà â âèäå êîæíûõ ãåìîððàãèé ðàçëè÷íîé âûðàæåííîñòè (íåðåäêî ýòî îáøèðíûå ýêõèìîçû), ìîãóò íàáëþäàòüñÿ íîñîâûå êðîâîòå÷åíèÿ. Ãåìîððàãè÷åñêèé ñèíäðîì îáóñëîâëåí õðóïêîñòüþ ñòåíîê êðîâåíîñíûõ ñîñóäîâ è íà îïðåäåëåííîì ýòàïå ðàçâèòèÿ áîëåçíè ìîæåò ñòàòü âàæíåéøèì êëèíè÷åñêèì ïðîÿâëåíèåì.
Äèàãíîñòèêà íåñîâåðøåííîãî îñòåîãåíåçà îáû÷íî íåñëîæíà ïðè íàëè÷èè ïðè íàëè÷èè êàðäèíàëüíûõ êëèíè÷åñêèõ ïðèçíàêîâ çàáîëåâàíèÿ: ÷àñòûõ ïåðåëîìîâ; ãîëóáûõ ñêëåð; ãëóõîòû èëè ñíèæåíèÿ ñëóõà; íåñîâåðøåííîãî äåíòèíîãåíåçà; ñåìåéíûõ ñëó÷àåâ áîëåçíè; âûðàæåííîé îñòåîïåíèè.
Òåñò-êîíòðîëü ê ðàçäåëó ²Y -Â
40. Íåñîâåðøåííûé îñòåîãåíåç — çàáîëåâàíèå, õàðàêòåðèçóþùååñÿ:
A. Ñêåëåòíî-ìûøå÷íîé è ñåðäå÷íî-ñîñóäèñòîé ñèñòåì, ïàòîëîãèåé ãëàç
B. Ïàòîëîãèåé ýíäîêðèííîé ñèñòåìû
C. Îñòåîïåíèåé, õðóïêîñòüþ êîñòåé
D. Ïîðàæåíèåì ñâÿçî÷íîãî àïïàðàòà, ñóõîæèëèé
E. Ïàòîëîãèåé öåíòðàëüíîé íåðâíîé ñèñòåìû
41. Âûáåðèòå êðèòåðèè, ïî ñòåïåíè âûðàæåííîñòè êîòîðûõ, âûäåëÿþò òèïû íåñîâåðøåííîãî îñòåîãåíåçà:
A. Ëîìêîñòü êîñòåé, ãîëóáûå ñêëåðû, àíîìàëèè çóáîâ, ãëóõîòà
B. Ãèïåðìîáèëüíîñòü ñóñòàâîâ, õðóïêîñòüþ êîñòåé
C. Ïîðàæåíèå ñâÿçî÷íîãî àïïàðàòà, ñóõîæèëèé
D. Ãåìîððàãè÷åñêèé ñèíäðîì, îñòåîïåíèÿ
Ðàçäåë ²Y -Ã. ÝËÀÑÒÈ×ÅÑÊÀß ÏÑÅÂÄÎÊÑÀÍÒÎÌÀ
Ýëàñòè÷åñêàÿ ïñåâäîêñàíòîìà — âðîæäåííîå çàáîëåâàíèå ñîåäèíèòåëüíîé òêàíè, õàðàêòåðèçóþùååñÿ êàëüöèôèêàöèåé ýëàñòèíîâûõ âîëîêîí. Îñíîâíîé ãåíåòè÷åñêèé äåôåêò çàáîëåâàíèÿ íåèçâåñòåí, õîòÿ ïðåäïîëàãàþò ðîëü ìóòàöèè ãåíîâ, êîäèðóþùèõ ñèíòåç ýëàñòèíà, ôèáðèëëèíà, ëèçèëîêñèäàçû.
Êîæíûå ïðîÿâëåíèÿ áîëåçíè âêëþ÷àþò ïîÿâëåíèå æåëòûõ ïÿòåí íà êîæå â îáëàñòè øåè, ïîäìûøå÷íûõ âïàäèí èëè äðóãèõ ìåñòàõ â îáëàñòè ñãèáàòåëüíîé ïîâåðõíîñòè ñóñòàâîâ. Âîçìîæíî íàðóøåíèå çðåíèÿ âñëåäñòâèå ðàçðûâîâ ýëàñòèíñîäåðæàùèõ ìåìáðàí ñîñóäîâ ñåò÷àòêè.
Ñåðäå÷íî-ñîñóäèñòûå íàðóøåíèÿ îáóñëîâëåíû êàëüöèôèêàöèåé âíóòðåííåé ýëàñòè÷åñêîé ìåìáðàíû àðòåðèé.
Ãåìîððàãè÷åñêèé ñèíäðîì ïðè ýëàñòè÷åñêîé ïñåâäîêñàíòîìå îáóñëîâëåí ðàçðûâîì êàëüöèôèöèðîâàííûõ ñîñóäîâ è ïðîÿâëÿåòñÿ êîæíûìè êðîâîèçëèÿíèÿìè, íîñîâûìè êðîâîòå÷åíèÿìè, ìåòðîððàãèÿìè, ðåäêî — âíóòðèñóñòàâíûìè êðîâîèçëèÿíèÿìè. Ó 13% áîëüíûõ íàáëþäàþòñÿ ãàñòðîèíòåñòèíàëüíûå êðîâîòå÷åíèÿ (÷àùå â âîçðàñòå 20-30 ëåò).
Òåñò-êîíòðîëü ê ðàçäåëó ²Y -Ã
42. Ýëàñòè÷åñêàÿ ïñåâäîêñàíòîìà — çàáîëåâàíèå, õàðàêòåðèçóþùååñÿ:
A. Ñêåëåòíî-ìûøå÷íîé è ñåðäå÷íî-ñîñóäèñòîé ñèñòåì, ïàòîëîãèåé ãëàç
B. Êàëüöèôèêàöèåé ýëàñòèíîâûõ âîëîêîí
C. Îñòåîïåíèåé, õðóïêîñòüþ êîñòåé
D. Ïîðàæåíèåì ñâÿçî÷íîãî àïïàðàòà, ñóõîæèëèé
43. Êëèíè÷åñêèå ïðîÿâëåíèÿ ýëàñòè÷åñêîé ïñåâäîêñàíòîìû çàêëþ÷àþòñÿ â:
A. Àíîìàëèè ñòðîåíèÿ ñêåëåòíî-ìûøå÷íîé ñèñòåìû,
B. Ïîÿâëåíèè æåëòûõ ïÿòåí íà êîæå, êàëüöèôèêàöèåé àðòåðèé, ãåìîððàãèÿìè
C. Îñòåîïåíèè, õðóïêîñòè êîñòåé, ïàòîëîãèè ãëàç
D. Ïîðàæåíèè ñâÿçî÷íîãî àïïàðàòà, ñóõîæèëèé
ÝÒÀËÎÍÛ ÎÒÂÅÒÎÂ ÍÀ ÒÅÑÒ-ÊÎÍÒÐÎËÜ
1 | Ñ | 11 | B | 21 | A | 31 | C | 41 | A |
2 | Ñ | 12 | A | 22 | C | 32 | B | 42 | B |
3 | D | 13 | A | 23 | E | 33 | B | 43 | B |
4 | A | 14 | À | 24 | B | 34 | B | ||
5 | C | 15 | D | 25 | F | 35 | D | ||
6 | E | 16 | D | 26 | B | 36 | A | ||
7 | B | 17 | B | 27 | B | 37 | A | ||
8 | D | 18 | A | 28 | A | 38 | B | ||
9 | B | 19 | D | 29 | B | 39 | A | ||
10 | B | 20 | C | 30 | D | 40 | C |
ËÈÒÅÐÀÒÓÐÀ
ÎÑÍÎÂÍÀß:
1. Äèòÿ÷³ õâîðîáè. / çà ðåä. Â.Ì.Ñèäåëüí³êîâà, Â.Â. Áåðåæíîãî. — Ê. Çäîðîâ’ÿ, 1999. — 734ñ.
2. Ìàéäàííèê Â.Ã. Ïåäèàòðèÿ (2-å èçä.) — Õ.: Ôîëèî, 2002. — 1125ñ.
3. Ñì³ÿí ².Ñ. Ïåäûàòðûÿ (Öèêë ëåêöûé). — Òåðíîïûëü.: Óêðìåäêíèãà, 1999. — 712ñ.
4. Íåîòëîæíûå ñîñòîÿíèÿ ó äåòåé / Ïîä ðåä. Â.Ì.Ñèäåëüíèêîâà. — Ê.: Çäîðîâüå, 1994.
5. Øàáàëîâ Í.Ï. Äåòñêèå áîëåçíè: Ó÷åáíèê (5-å èçä.). — ÑÏá.: Ïèòåð, 2002. — Ò.1 — 832ñ., Ò2. — 736ñ.
6. Ìåäèöèíà äèòèíñòâà / çà ðåä.. Ï.Ñ. Ìîùè÷à. — Ê.: Çäîðîâ’ÿ, 1994-2001.- Ò. 1-6.
7. Ïåäèàòðèÿ / Ïîä ðåä. Ð.Å. Áåðìàíà; Â.Ê. Âîãàíà. — Ì.Ìåäèöèíà, 1991. — Êí. 1-8.
8. Ïåäèàòðèÿ / Ïîä ðåä. Äæ.Ãðåôå. — Ì.: Ïðàòèêà, 1997. — 912ñ.
9. Øàáàëîâ Í.Ï. Íåîíàòîëîãèÿ. — ÑÏá.: Ñïåöèàëüíàÿ ëèòåðàòóðà, 1996. — Ò.1.- 494ñ., Ò2.- 505ñ.
10. Âîçèàíîâ À.Ô., Ìàéäàíèê Â.Ã., Áèäíûé Â.Ã., Áàãäàñàðîâà è.Â. îñíîâû íåôðîëîãèè äåòñêîãî âîçðàñòà. — Ê. Êíèãà ïëþñ, 2002. — 348ñ.
11. Áåëîóñîâ Þ.Â. Ãàñðîýíòåðîëîãèÿ äåòñêîãî âîçðàñòà. — Õ.:êîíñóì, 200.- 528ñ.
12. Ðåçíèê Á.ß., Çóáàðåíêî À.Â. Ïðàêòè÷åñêàÿ ãåìàòîëîãèÿ äåòñêîãî âîçðàñòà. — Ê.: Çäîðîâüå, 1989.
ÄÎÏÎËÍÈÒÅËÜÍÀß:
1. Ãîðáóíîâà Â.Í. Ìîëåêóëÿðíûå îñíîâû ìåäèöèíñêîé ãåíåòèêè. — ÑÏá., 1999. — 212 Ñ.
2. Äèñïëàçèÿ ñîåäèíèòåëüíîé òêàíè. Ìàòåðèàëû ñèìïîçèóìà. /Ïîä ðåä. Ã.È. Íå÷àåâîé. — Îìñê. — Èçä-âî ÎÃÌÀ. — 168 Ñ.
3. Âèêòîðîâà È.À. Ìåòîäîëîãèÿ êóðàöèè ïàöèåíòîâ ñ äèñïëàçèåé ñîåäèíèòåëüíîé òêàíè ñåìåéíûì âðà÷îì â àñïåêòå ïðîôèëàêòèêè ðàííåé è âíåçàïíîé ñìåðòè. — Àâòîðåôåðàò äèññåðòàöèè íà ñîèñêàíèå ó÷¸íîé ñòåïåíè äîêòîðà ìåäèöèíñêèõ íàóê. — Îìñê. — 2004. — 43 Ñ.
4. Çåìöîâñêèé Ý. Â. Ñîåäèíèòåëüíîòêàííûå äèñïëàçèè ñåðäöà. — ÑÏá., 1998.— 94 Ñ.
5. Êàäóðèíà Ò.È. Íàñëåäñòâåííûå êîëëàãåíîïàòèè (êëèíèêà, äèàãíîñòèêà, ëå÷åíèå, äèñïàíñåðèçàöèÿ). — ÑÏá., 2000. — 271 Ñ.
6. Êëåìåíîâ À.Â. Êëèíè÷åñêîå çíà÷åíèå íåäèôôåðåíöèðîâàííîé äèñïëàçèè ñîåäèíèòåëüíîé òêàíè. — Àâòîðåôåðàò äèññåðòàöèè íà ñîèñêàíèå ó÷¸íîé ñòåïåíè äîêòîðà ìåäèöèíñêèõ íàóê. — Ì. — 2005.
7. ßêîâëåâ Â.Ì. / Â.Ì. ßêîâëåâ, Ã.È. Íå÷àåâà // Êàðäèî-ðåñïèðàòîðíûå ñèíäðîìû ïðè äèñïëàçèè ñîåäèíèòåëüíîé òêàíè. — Îìñê, 1994. — 217 Ñ.
Ðàçìåùåíî íà Allbest.ru
Источник
