Стимуляция головного мозга при болезни паркинсона


Болезнь Паркинсона, как правило, наблюдается у людей старшего возраста и реже встречается у молодых людей. Несмотря на то, что причины заболевания «Паркинсона», которое сопровождается повреждением глубоких ядер в базальных ганглиях ткани мозга и нарушением анатомических структур небольшого размера, рассматриваются как генетические и экологические факторы, по этому вопросу отсутствует точная информация. Данное заболевание возникает в связи с уменьшением в организме количества некоторых веществ, способствующих передаче нервных клеток, и потерей нервных клеток. Наиболее важным веществом является «допамин». Доцент Ахмет Хильми Кая, специалист в области нейрохирургии медицинского центра «Анадолу», рассказывает о хирургическом лечении заболевания «Паркинсона», которое наиболее распространенно проявляется нарушением движения.
Пациент постепенно становится неработоспособным
Основные признаки болезни Паркинсона — это тремор (дрожь), жесткость движений (ригидность), брадикинезия (замедленность движений) и дисбаланс. У большинства пациентов обнаруживается нарушение когнитивных функций (когнитивный статус), т.е. слабоумие. Тремор рук и ног обычно начинается с одной стороны, с течением времени может стать двусторонним. Жесткость совместных действий различных типов групп мышц пациентов, которые работают не скоординировано, приводит к затруднению движения. Все эти проявления могут сопровождаться замедлением движения (брадикинезией). Эти симптомы свидетельствуют о различной интенсивности и степени заболевания. Ахмет Хильми Кая, д-р, доц., отмечает: “Это заболевание на практике приводит к тому, что пациент не может ходить, не может двигаться быстрее, не имеет равновесия, не в состоянии двигаться без помощи посторонних, даже в домашних условиях, не может есть, не может держать столовые приборы и стакан воды. Со временем пациент не сможет обеспечивать собственные потребности.
Первый вариант лечения — это лекарства!
Болезнь Паркинсона, которая снижает качество жизни человека и повышает зависимость от людей и окружающей среды, имеет два разных метода лечения. Один из этих методов –это медикаментозное лечение, а другой — хирургическое вмешательство. На ранних стадиях заболевания с высокой эффективностью применяются различные лекарства. Регулярное применение лекарственных препаратов может обеспечить почти полное исчезновение всех признаков заболевания. В связи с этим основными последующими мероприятиями для пациентов, имеющими большое значение, является контроль в отделении неврологии. Диагностика болезни, лекарственная терапия и эффективность лечения, наличие побочных эффектов – всё это определяется неврологами. При принятии решения об операции этих пациентов, после хирургического вмешательства, необходимо проведение контроля специалистов отделения неврологии. Лекарственная терапия, которая в начале заболевания является чрезвычайно эффективной, в течение многих лет дает хорошие результаты, однако приводит к некоторым побочным эффектам в частности, дискинезии (нарушение движений). При дискинезии появляются непроизвольные движения меньшей или большей части тела, которые могут быть описаны, как рывки или скручивания.
 Стимулирование структур головного мозга
Стимулирование структур головного мозга
На сегодняшний день к хирургическуму лечению прибегают реже, хотя при определенных формах болезни хирургическое вмешательство бывает необходимо. Оперативное лечение показано в тех случаях, когда пациент находится в сравнительно молодом возрасте и у него сильный тремор, не поддающийся соответствующему медикаментозному лечению. Эта операция сравнительно небольшая по объёму и производится через отверстие, проделанное в черепе под местным наркозом. Для этого применяется специальное зафиксированное на черепе устройство — стереотаксический аппарат. Операция связана со сравнительно небольшим риском и в настоящее время является самым эффективным методом лечения дрожания. Доц. Ахмет Хильми Кая отмечает, что билатеральная стимуляция внутреннего сегмента бледного шара (Globus Pallidus internus) или субталамического ядра показана как дополнительное лечение поздних стадий болезни Паркинсона у пациентов, отвечающих на леводопа-содержащую терапию в том случае, если консервативное лечение не позволяет получить адекватный результат. Одним из направлений в хирургическом лечении болезни Паркинсона является проведение стереотаксических вмешательств на глубинных структурах головного мозга (применение клеток головного мозга) с разрушением определенных подкорковых ядер или имплантацией нейростимуляторов, что приводит к значительному регрессу симптомов, снижению дозировки принимаемых противопаркинсонических средств и повышению уровня социальной и бытовой адаптации пациентов.
Нейростимуляторы могут использоваться в течение семи лет
Этапы хирургического лечения: изображение, ориентация на цель подачи тока на аккумулятор, помещение электрода, установка стимуляторов с подключением к электродам системы. Сначала проводится исследование пациента методом МРТ, по специальному программному обеспечению определяются основные зоны действия. Ориентация на первых ячейках, под местной анестезией на участок черепа пациента помещается неподвижная рама (стереотаксическая рама). Последующие исследования КТ и имеющиеся данные исследования МРТ объединяются в специальном программном обеспечении и определяются математические координаты точек, имеющихся в мозгу. После определения точек ядер, в операционной в эти точки устанавливаются концы электродов. Процедура проводится через отверстия в черепе пациента. В этот момент предпочитается применение местной анестезии. После размещения электродов в мозгу под общим наркозом, устанавливаются стимуляторы, и эти стимуляторы подключаются к электродам. Стимуляторы, как правило, устанавливаются под кожей в нижней части правой области ключицы, а другие концы электродов, помещенных в мозгу, чтобы создать туннель под кожей, подключаются к кабелям устройств, обеспечивающих промежуточное «Ди-и-эс-эй» (DESA) действие с помощью аккумулятора. Доц. Ахмет Кая Хильми отмечает, что после операции вне тела не остается никаких устройств, но стимулятором можно управлять извне, и продолжает: “Как правило, стимулятор включается через 48 часов после операции. Срок службы стимуляторов, в среднем, от четырех до семи лет. Однако, когда стимулятор заменяется, не нужно снова делать операцию на головном мозге, а только открывается участок ниже ключицы, и старый стимулятор заменяется новым. Этот процесс завершается в течение 30 минут».
Риски сопоставляются с преимуществами
Глубокая стимуляция мозга (применение стимулятора головного мозга) имеет риск ниже, чем у классических операций головного мозга. Например, электрод помещается в отверстия в черепе, и при этом не оказывается каких-либо серьезных воздействий на мозг. Однако, есть риск кровотечения во время направления электрода к цели. Доц. Ахмет Хильми Кая отмечает, что благодаря исследованиям до операции данный риск уменьшается до 1%, и продолжает: “Единичное кровотечение не может вызвать серьезных последствий. Альтернатива — повышение точности метода ориентации с использованием изображений во время операции — обеспечивает дальнейшее снижение риска кровотечений. Однако, хотя риск является небольшим, перед операцией нужно проинформировать пациентов и их родственников о возможных последствиях операции “. Один из рисков, возникающих при хирургическом лечении, — это инфекции. Эту проблему можно решить с помощью лекарственных препаратов, однако при отсутствии такой возможности, нужно снять стимулятор, для лечения инфекции. Этот риск составляет 1%. На данный момент, при необходимости операции, очень важно знать о минимальных рисках применяемой процедуры.
Пациент может сам пить чай
При лечении пациентов с болезнью Паркинсона сами пациенты и их семья не должны забывать, что применение стимулятора головного мозга не исключает полностью болезнь, а только улучшает состояния здоровья. Необходимо понимать, что действие метода глубокой стимуляции мозга носит симптоматический характер и не влияет на дегенеративные процессы, лежащие в основе заболевания. При этом методе наблюдается улучшение, в разных пропорциях, в таких патологических состояниях, как озноб, жесткость тела и замедленность движений. Цель операции достигается, благодаря средним дозам препарата, полученного пациентом в течение первого года болезни, и заключается в улучшении состояния здоровья и задержке развития болезни. Большое значение имеет контроль невролога после операции. Пациенты, установившие нейростимулятор, по-прежнему могут, при появлении возможности, воспользоваться другими методами лечения, среди которых генная терапия или лечение стволовыми клетками. После операции пациент может ходить без посторонней помощи, может двигаться более легко, чем раньше, пациент, который не мог держать стакан воды, легко может пить чай.
Видео о пациентах, страдающих болезнью Паркинсона, ДО и ПОСЛЕ проведенного лечения.
Читайте также:
Нейрохирургия в «Анадолу» >>
Болезнь Паркинсона и эпилепсию побеждают в Стамбуле >>
Эпилепсия: судороги в тупиках мозга >>
Источник
Стереотаксис (от греч. stereos – пространственный, taxis — расположение) – раздел в современной нейрохирургии, где для проведения операций используются специальная аппаратура и технология для определения точных координат интересующей зоны в головном мозге с последующими манипуляциями на ней. Современные стереотаксические аппараты позволяют определить местоположение искомой структуры в головном мозге с точностью до 1 мм, что обеспечивает безопасность проводимых операций. Выбор мишени (точки цели) осуществляется по монитору компьютера после проведенного томографического исследования головного мозга. Из существующих стереотаксических методов наиболее современным и чрезвычайно эффективным у данной категории пациентов является глубокая (глубинная) электростимуляция головного мозга (DBS).
Глубинная стимуляция головного мозга является (ГСГМ) важной, доминирующей частью лечения пациентов с болезнью Паркинсона, у которых двигательные расстройства не поддаются медикаментозной терапии. Клинические исследования показали, что улучшение качества жизни после ГСГМ превышает наилучшую медикаментозную терапию, но при условии правильного отбора больных.
ГСГМ заключается в высокочастотной электрической стимуляции глубинных ядер головного мозга — субталамического ядра или паллидума (бледного шара). При ГСГМ электроды вживляются в необходимую цель (см. далее) — процедуру можно сравнить с установкой электро-кардио-стимулятора, который посылает импульсы к сердечной мышце, заставляя ее сокращаться, только в данном случае импульсы воздействуют на определенные нервные структуры головного мозга, при этом параметры стимуляции могут изменяться для того, чтобы увеличить положительные эффекты и уменьшить побочные. Если лечение неэффективно, то электроды могут быть переставлены или удалены вовсе, причем без каких-либо последствий. В виду вышесказанного, ГСГМ стала методом выбора для лечения двигательных расстройств болезни Паркинсона, по сравнению с деструктивными операциями, при которых «неудачная» деструкция нервных структур, вовлеченных в процесс, и производимая путем химического разрушения, замораживания или электрической коагуляции, вызывает развития серьезных, но необратимых побочных эффектов. Помимо «обратимости» процедуры и её результатов ГСГМ также имеет следующие преимущества:
► устройство для глубокой стимуляции мозга настраивается в зависимости от индивидуальных особенностей пациента;
► при появлении необходимости пациенты, которым установлен прибор для глубокой стимуляции мозга могут воспользоваться и другими средствами терапии, например, медикаментозной.
В конце 1900-х-начале 2000-х гг. вентральное промежуточное ядро (VIM) таламуса было наиболее используемой целью (таламическая стимуляция). Однако стимуляция VIM имела недостаточный эффект на ригидность и брадикинезию, наиболее частые симптомы болезни Паркинсона. В результате стимуляция VIM применяется у ограниченного количества пациентов с тремор-предоминантной болезнью Паркинсона. Стимуляция globus pallidus interna (GPi) — паллидарная стимуляция, — также эффективно для лечения тремора и также снижает проявления дискинезии, ригидности и брадикинезиии, улучшает постуральную стабильность. Стимуляция субталамических ядер (subthalamic nucleus — STN) аналогична стимуляции GPi в плане лечения ригидности, брадикинезии и тремора, и также приводит в снижению дозы противо-паркинсонических препаратов, что приводит к уменьшению медикаментозных дискинезий.
ГСГМ показана тем пациентов с болезнь Паркинсона, у которых:
► длительность заболевания составляет пять лет и больше и при этом невозможно достичь адекватного контроля заболевания при помощи лекарственных препаратов;
► имеется снижение качества жизни из-за гипокинетических флюктуации и/или дискинезий, и/или тремора;
► во время теста с леводопой отмечается уменьшение выраженности двигательных расстройств на 50% и более (исключение: дрожательная форма болезни Паркинсона);
► в лучшем медикаментозном периоде «включения» 3 балла и менее по шкале Хена-Яра.
Если у пациента имеется: деменция и/или тяжелая инвалидизация даже в наилучшем периоде «включения», т.е. неэффективность проводимой терапии препаратами леводопы и/или общемедицинские противопоказания к хирургическому лечению, тогда он исключается из кандидатуры на хирургическое (ГСГМ) лечение.
Более подробную информацию об отборе пациентов с болезнью Паркинсона для ГСГМ вы можете получить в статье «Алгоритм отбора пациентов с болезнью Паркинсона для хирургического лечения с применением глубокой стимуляции мозга Т.Б. Загоровская, А.В. Ширшов, С.Н. Иллариошкин (2010) [ЧИТАТЬ].
ГСГМ осуществляется системой, состоящей из нескольких компонентов:
► электрод – тонкий изолированный провод с открытым концом, который внедряется в вещество мозга через небольшое отверстие в костях черепа;
► нейростимулятор – это устройство, которое генерирует нервные импульсы, оно размещается под кожей в области ключицы (другими вариантами размещения нейростимулятора являются подкожная область груди или брюшная полость);
► подкожная система проводов – благодаря ней удается поместить генератор сигналов на удалении от головного мозга (провода проходят под кожей плеч, шеи, головы).
Процедуру установки нейростимулятора проводят в два этапа. Первый из них проводится под местным обезболиванием. При этом в области черепа выполняется небольшое отверстие, позволяющее получить доступ к веществу головного мозга. Введение электрода в структуры головного мозга не вызывает никаких неприятных ощущений, так как ткань в данной области не обладает болевыми рецепторами. Применение же лишь местного обезболивания дает возможность контролировать неврологические функции уже в момент проведения оперативного вмешательства. Для того чтобы эффективно устранить тремор и другие неврологические нарушения хирург должен точно определить зону головного мозга, ответственную за эти патологические симптомы. Для этого используется система трехмерной компьютерной навигации. Это высокотехнологичное оборудование позволяет определить анатомические области мозга и без труда провести манипуляцию с высокой точностью. После проведения процедуры установки устройство в течение нескольких недель настраивается для оптимальной работы. Это осуществляется при помощи специальных магнитов. После подтверждения эффективности работы прибора приступают ко второму этапу процедуры – установке нейростимулятора. Под общей или местной анестезией устройство вводится под кожу в области ключицы. По окончании проведения всех этапов установки прибора для глубокой стимуляции мозга пациенту выдается магнитный пульт, при помощи которого он может регулировать работы устройства. Батареек, которыми оснащен нейростимулятор, хватает на 5 — 10 лет работы. По истечении этого периода времени проводится простая процедура по замене элемента питания или самого устройства.
Как и любая операция на головном мозге, процедура установки прибора для глубокой стимуляции может иметь некоторые побочные эффекты. К ним относятся: временное ощущение покалывания на одной половине лица или в конечностях, аллергические реакции, преходящие болезненные ощущения в области имплантации, головокружение, расстройство координации, временное нарушение зрения, речи, двигательной активности.
читайте также статью «Современные возможности хирургической нейромодуляции» А.О. Гуща, В.М. Тюрников, А.А. Кащеев; ФГБНУ «Научный центр неврологии», Москва (журнал «Анналы клинической и экспериментальной неврологии» №5, 2018) [читать]
Источник
Эффективность глубокой стимуляции мозга при болезни Паркинсона
Обе цели, бледный шар и субталамическое ядро, сравнивались в рандомизированных исследованиях по оценке улучшения с помощью единой рейтинговой шкалы болезни Паркинсона (UPDRS). В исследовании Krack et al. в категории двигательных расстройств отмечено улучшение в 71% для группы стимуляции субталамического ядра (без лекарств), а в группе стимуляции бледного шара показатель был лишь 39% из-за менее выраженного влияния на акинезии. Тем не менее, в небольшом рандомизированном проспективном исследовании Burchiel et al. не нашли значительной разницы в двигательной сфере в обеих группах.
В нерандомизированном проспективном исследовании, пациенты были оценены через три месяца после хронической глубокой стимуляции мозга (ХГСМ) субталамического ядра (96 больных) и ХГСМ бледного шара (38 пациентов). Леводопа-индуцированные дискинезии были на том же уровне в обеих группах, в то время как другие моторные показатели указывали на более выраженное улучшение в группе стимуляции субталамического ядра.
Однако через шесть месяцев снижение дискинезии было выше в группе хронической глубокой стимуляции мозга (ХГСМ) субталамического ядра, чем в группе стимуляции бледного шара (74% против 64%). Имеющиеся на сегодняшний день данные показывают умеренное преимущество хронической глубокой стимуляции мозга (ХГСМ) субталамического ядра для моторной дисфункции. Кроме того, снижение дозы лекарств возможно при хронической глубокой стимуляции мозга (ХГСМ) субталамического ядра, но не хронической глубокой стимуляции мозга (ХГСМ) бледного шара.
Эквивалент леводопы при хронической глубокой стимуляции мозга (ХГСМ) субталамического ядра может быть уменьшен на 65% по сравнению с предоперационной дозой. Еще одним недостатком хронической глубокой стимуляции мозга (ХГСМ) бледного шара является высокий расход энергии для эффективной стимуляции.
В соответствии с критериями доказательной медицины, субталамическое ядро стало основной мишенью для ХГСМ. Двусторонние имплантации двух ХГСМ электродов, подключенных к одной ИГИ, являются стандартной процедурой. Это приводит к улучшению основных проявлений БП. В среднем показатель двигательных параметров почти во всех исследованиях колеблется от 40 до 70%.
После 12 месяцев хроническая глубокая стимуляция мозга (ХГСМ) субталамического ядра, по сравнению с предоперационным состоянием тремор уменьшился на 81%, ригидность на 63%, брадикинезия на 52%, нарушения походки на 64% и постуральная неустойчивость на 69%. Дискинезии улучшаются у пациентов с ХГСМ субталамического ядра примерно на 75%. Снижение дискинезии, вероятно, связано с сокращением дозы лекарств и отсроченным прямым эффектом. «On-off» колебания, Off-период дистонии и связанные с ним боли также уменьшаются при стимуляции. Долгосрочные исследования ГСМ субталамического ядра показывают значительный и устойчивый эффект в отношении моторных симптомов иногда в течении пяти лет.
Глубокая стимуляция мозга (ГСМ) субталамического ядра оказывает нейропротекторное действие — возможно, связанное с подавлением токсичности глутамата и снижением гибели клеток в черном веществе. Однако как показано по данным ПЭТ прогрессирование заболевания у пациентов с распространенной болезнью Паркинскона (БП) продолжается, несмотря на то, что они получили эффективное стимулирование в соответствии с улучшенной шкалой UPDRS.
В немецком многоцентровом исследования в двух группах были изучены 156 пациентов с поздними стадиями болезни Паркинсона (БП) и тяжелыми двигательными нарушениями, сравнивались результаты лечения ХГСМ в сочетании с медикаментозной терапией и результаты в группе получавшей только лекарственные препараты. Через шесть месяцев наблюдения результаты были лучше в группе пациентов с ХГСМ, деятельность в повседневной жизни, эмоциональное благополучие, телесный дискомфорт были улучшены на 24-38%.
В другом исследовании оценивалось влияние возраста. У 52 пациентов с болезнью Паркинсона (БП) улучшение двигательных функций составило 62% у пациентов моложе 60 лет, 37% в возрасте 60-70 лет и лишь 22% среди тех, кто был старше 70 лет. В то время как отмечено влияние на двигательные симптомы, существенное влияние на речь, замерзание и психологические симптомы, такие как депрессия, не связанные со слабоумием, отсуствуют. Влияние ГСМ субталамического ядра на когнитивные функции пациентов с болезнью Паркинсона (БП) было оценено в нескольких исследованиях.
В швейцарском исследовании, из 57 пациентов с болезнью Паркинсона (БП), которые подверглись глубокая стимуляция мозга (ГСМ) субталамического ядра у 24,5% развилась деменция, соответствующая критериям деменции болезни Паркинсона (БП). Остальная часть пациентов оставалась когнитивно стабильной в течение трех лет (DSM-IV и UPDRS шкалы). Частота ухудшений когнитивных функций была такой же, как у пациентов с болезнью Паркинсона (БП) при консервативном лечении. По крайней мере, большинство опубликованных данных говорит о том, что ГСМ субталамического ядра незначительно влияет на познавательные способности.
Тем не менее, некоторые подгруппы пациентов (старшего возраста) находятся в более высокой группе риска развития когнитивных и нейроповеденческих нарушений. Недостатком ГСМ субталамического ядра является необходимость в более сложной регулировке стимуляции и препаратов леводопы для конкретного пациента в послеоперационном периоде. В некоторых случаях после ГСМ субталамического ядра могут возникать побочные психиатрические реакции. Переходная ангедония не является редкостью. Начало или ухудшение существующей депрессии после операции происходит у небольшого процента пациентов, поэтому необходима предоперационная психоневрологическая оценка, и в послеоперационном периоде она также является важной частью наблюдения за пациентом.
У большинства пациентов сразу после операции появились поведенческие побочные эффекты, которые уменьшились в долгосрочной перспективе без специфической терапии. Возникновение нервно-психических побочных эффектов, в таких случаях является многофакторным.

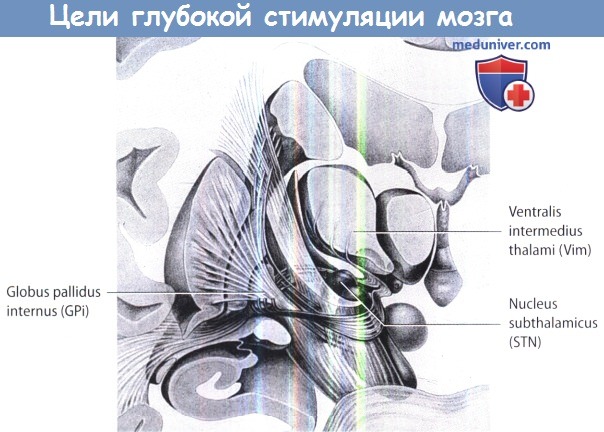
Общие анатомические цели для глубокой стимуляции мозга.

Анатомические цели для глубокой стимуляции мозга при лечении двигательных расстройств.
— Также рекомендуем «Эффективность глубокой стимуляции мозга при дистонии»
Оглавление темы «Глубокая стимуляция мозга (ГСМ).»:
- Хроническая глубокая стимуляция мозга (ХГСМ) при двигательных расстройствах
- Эффективность глубокой стимуляции мозга при треморе
- Эффективность глубокой стимуляции мозга при болезни Паркинсона
- Эффективность глубокой стимуляции мозга при дистонии
- Перспективы развития глубокой стимуляции мозга
Источник
