Жалобы при ишемической болезни сердца у
НИИ кардиологии им. А.Л.Мясникова РКНПК Минздрава РФ, Москва
Один из основных постулатов медицины гласит, что оптимальное лечение заболевания невозможно без знания его причины. Однако этот принцип трудно применим, когда речь заходит о хронической сердечной недостаточности (ХСН). Это связано с тем, что, хотя болезни, приводящие к развитию ХСН, многочисленны и разнообразны, финальный итог для всех один — декомпенсация сердечной деятельности. Возникает иллюзия, что причина ХСН уже не имеет значения и лечение во всех случаях одинаково: будь то ишемическая болезнь сердца (ИБС), дилатационная кардиомиопатия (ДКМП) или гипертоническое сердце. Однако это не так. Любая болезнь, лежащая в основе ХСН, имеет свои особенности, откладывающие отпечаток на течение сердечной недостаточности, ее терапию и прогноз. Тем более это относится к такому частому и серьезному заболеванию, каким в настоящее время является ИБС.
Эпидемиология
В настоящее время считается доказанным, что ИБС является основной этиологической причиной развития сердечной недостаточности. Этот вывод можно сделать на основании анализа результатов специальных эпидемиологических исследований в популяциях, а также по оценке контингента больных, включенных в многоцентровые исследования по выживаемости больных ХСН. Так, в 10 таких исследованиях, проведенных в последние годы, ишемическая этиология декомпенсации была отмечена в среднем у 64% больных (табл. 1). Разброс результатов этих исследований объясняется различием диагностических критериев ИБС, используемых в разных центрах, популяционными различиями, а также может быть связан с исследуемым препаратом. Так, в работах, связанных с b-блокаторами (в табл. — это исследования CIBISI и USCT), существенное место среди причин ХСН наряду с ИБС занимает ДКМП (36 и 52% соответственно); там же, где исследуются ингибиторы АПФ, основной причиной декомпенсации является, как правило, ИБС, а частота случаев ДКМП не превышает 22%.
Эпидемиологические исследования в популяциях также свидетельствуют о существенном преобладании ИБС среди основных причин развития ХСН (табл. 2). В исследовании распространенности ХСН в городе Глазго ИБС, как причина ХСН, наблюдалась у 95% больных (!). Из результатов этих же исследований следует, что артериальная гипертония также занимает значительное место в структуре причин развития ХСН, хотя в клинической практике гипертония чаще всего сочетается с ИБС. А вот роль ДКМП, как причины ХСН, в таких эпидемиологических исследованиях невелика и оценивается 0—11%.
В ретроспективном исследовании, проведенном в НИИ кардиологии им. А.Л. Мясникова, также было выявлено, что ИБС в последние годы стала главной причиной развития сердечной недостаточности [2], причем “вклад” ИБС в общую структуру заболеваемости ХСН постоянно увеличивается (табл. 3).
Патофизиология сердечной недостаточности при ИБС
Механизмов развития и прогрессирования сердечной недостаточности при ИБС может быть несколько. Самым важным из них является, безусловно, инфаркт миокарда (ИМ). Внезапная “потеря” более или менее обширного участка сердечной мышцы приводит к развитию дисфункции желудочка(ов), и если больной не погибает (что бывает в 50% случаев), дисфункция со временем, как правило, манифестирует симптомами сердечной недостаточности. В исследовании TRACE [3] у 40% больных, перенесших ИМ, уже в первые дни отмечалась тяжелая дисфункция ЛЖ, причем у 65% это был первый в жизни инфаркт; у 74% из них вскоре развилась клиническая картина сердечной недостаточности. Однако и те 60% больных, которым удается избежать развития дисфункции на раннем этапе заболевания, не могут считать себя в “безопасности”. За обширным инфарктом следуют изменения сердечной мышцы, получившие название “ремоделирование” сердца. Этот феномен включает в себя процессы, затрагивающие пораженную область и здоровые участки миокарда, когда инфарктная зона “растягивается”, не в силах противостоять возросшему внутрижелудочковому давлению, а непораженные участки гипертрофируются и дилатируются, приспосабливаясь к новым условиям функционирования. Ремоделирование — процесс, который включает изменение во времени формы и функции желудочков, экспансию рубцовой ткани, что тесно сопряжено с изменением нейрогуморального фона организма.
Однако особенности развития ХСН у больных ИБС обусловлены не только желудочковой дисфункцией, но также постоянным участием в этом процессе коронарной недостаточности.
Частые эпизоды локальной ишемии приводят к периодам усиления локальной систолической дисфункции, проявляющейся одышкой (эквивалент стенокардии). Так, например, в исследовании SOLVD 37% больных ХСН предъявляли жалобы также на стенокардитические боли [4]. Частые эпизоды появления и исчезновения ишемии способствуют продлению систолической дисфункции в этих областях, что эквивалентно состоянию “оглушенного” (stunning) миокарда, описанного при окклюзии и последующем “открытии” соответствующей коронарной артерии. Персистирующая коронарная недостаточность вносит важный вклад в развитие как систолической, так и диастолической дисфункции ЛЖ.
Другой механизм систолической дисфункции у больных ИБС связан с таким явлением, как “гибернация” миокарда, являющимся адаптивной реакцией в условиях постоянно сниженного коронарного кровотока. Тканевая перфузия в этих условиях достаточна для поддержания существования кардиомиоцитов (в том числе ионных токов), но недостаточна для их нормальной сократимости. Этот процесс приводит к постепенной гипоконтрактильности всего миокарда и прогрессированию дисфункции ЛЖ. Последние данные свидетельствуют, что гибернация миокарда неизбежно заканчивается некрозом, если коронарный кровоток не возрастает.
Таким образом, вдобавок к таким необратимым изменениям, как постинфарктный рубец, еще присоединяются персистирующая ишемия миокарда, оглушенный и гибернированный миокард — все вместе вносят свою специфику в развитие ХСН у больных ИБС.
Еще одним важным фактором возникновения миокардиальной дисфункции у больных ИБС является нарушение функции эндотелия коронарных сосудов, свойственное этой патологии. Эндотелиальной дисфункцией принято обозначать нарушение способности этих клеток продуцировать специфические (сосудистые) факторы релаксации (NO, простациклин, фактор гиперполяризации). Доказано, что дисфункция эндотелия активизирует деятельность нейрогормонов, ответственных за развитие и прогрессирование ХСН: эндотелина-1, ренин-ангиотензин-альдостероновой и симпато-адреналовой систем, фактора некроза опухоли-a. Кроме того, эндотелиальная дисфункция у больных ИБС блокирует миграцию гладкомышечных клеток и их пролиферацию в стенке сосуда, увеличивает проницаемость стенки для липидов, что способствует дальнейшему развитию атеросклероза и коронарного тромбоза, который, в свою очередь, вызывает персистирующую ишемию миокарда и дисфункцию ЛЖ.
Эффективность медикаментозной терапии ХСН при ИБС
Дигоксин
В исследовании DIG [5] было показано, что у больных ХСН дигоксин на 26% увеличивает частоту развития ИМ, что косвенно может свидетельствовать о потенциально неблагоприятном влиянии гликозидов на течение ИБС. Это может быть связано с ростом потребления О2 на фоне увеличения сократимости миокарда. Несмотря на это, такой важный показатель, как риск развития смерти и/или вынужденной госпитализации из-за прогрессирования ХСН при применении дигоксина, все-таки имел тенденцию к снижению, хотя степень этого снижения у больных ИБС была менее значима (на 21%), чем у пациентов с ХСН неишемической этиологии (снижение на 33%).
Ингибиторы АПФ
Практически все клинические исследования свидетельствуют о выраженном положительном влиянии иАПФ не только на показатели смертности, но и на развитие ИБС, в том числе и у больных с ХСН или систолической дисфункцией миокарда. Так, по данным основных многоцентровых исследований, снижение риска развития ИМ при применении иАПФ у таких пациентов достигает 12—25% (рис. 1).
Успех применения иАПФ у больных ХСН ишемического генеза может быть связан с уникальным свойством препаратов этого класса улучшать не только гемодинамический и нейрогуморальный статус, но также нормализовать эндотелиальную функцию коронарных артерий, роль которой в патогенезе сердечной недостаточности в настоящее время уже не вызывает сомнений. Кроме того, иАПФ способствуют улучшению показателей фибринолитической активности плазмы, что оказывает профилактическое действие на развитие коронарного тромбоза.
Клиническим подтверждением собственно “антиишемических” свойств иАПФ могут служить результаты исследования QUIET, в котором добавление иАПФ квинаприла больным ИБС при сохраненной функции желудочков снижало частоту коронарных осложнений на 10% [6]. При сочетании ИБС с ХСН среднее снижение риска смерти, связанное с применением препаратов этого класса, достигает 23%, о чем свидетельствуют результаты метаанализа Garg&Yusuf, проведенного по результатам 32 плацебо-контролируемых исследований [7]. Другой важный вывод этого метаанализа свидетельствует о том, что в подгруппе больных с сердечной недостаточностью неишемической этиологии (не ИБС) эффект АПФ был также положительным, но все-таки несколько меньшим, чем у пациентов с ишемией миокарда (табл. 4).
Несмотря на такие благоприятные для больных ИБС предпосылки, в 2 крупнейших исследованиях с эналаприлом (V-HeFT II и SOLVD prevention & treatment) эффективность лечения сердечной недостаточности ишемической этиологии была существенно ниже, чем при декомпенсации неишемического генеза (см. табл. 4).
То, что действие иАПФ зависит от этиологии декомпенсации и может быть менее эффективным при ХСН ишемического генеза, было подтверждено в ретроспективном исследовании, проведенном в НИИ кардиологии им. А.Л. Мясникова. 6-летнее применение иАПФ у больных ХСН ишемической этиологии уменьшало риск их смерти в среднем на 26%, а у аналогичных больных с ДКМП — на 60% [2].
b-Блокаторы
Ишемия миокарда является одним из основных показаний к применению b-блокаторов, однако присоединение к ИБС недостаточности кровообращения до последнего времени считалось опасным для применения препаратов с отрицательными инотропными свойствами и служило даже противопоказанием для такой терапии. Тем не менее еще в 80-х годах было известно, что эффективность b-блокаторов у больных с ИМ, осложненным ХСН, даже выше, чем у пациентов без сердечной недостаточности (рис. 2).
После продолжительного периода поиска и колебаний целесообразность применения b-блокаторов в лечении больных ХСН перестала быть предметом дискуссий и стала очевидной лишь в последние 1—2 года, после завершения трех крупных многоцентровых исследований с карведилолом (USCT), бисопрололом (CIBIS II) и метопрололом (MERIT-HF).
Во всех этих работах применение b-блокаторов дополнительно к основной терапии (иАПФ+диуретики/гликозиды) уменьшало риск смерти в среднем на 34—65%. Причем положительный эффект терапии наблюдался в подгруппах больных как с ишемическим, так и неишемическим генезом сердечной декомпенсации.
Противоишемические и антиангинальные свойства b-блокаторов теоретически предполагают их преимущество при использовании у больных с ХСН ишемической этиологии. Однако в реальной клинической практике это подтверждается лишь отчасти. Как видно из табл. 5, при ИБС b-блокаторы имели недостоверное преимущество лишь в 2 исследованиях из 4. Более того, в одном из исследований (CIBIS I) бисопролол практически не влиял на смертность пациентов с ишемией миокарда при выраженном положительном эффекте у больных ДКМП.
Амиодарон
Эффективность амиодарона у больных с ИБС ассоциируется главным образом со снижением внезапной, аритмической смерти.
Так, в Канадском (CAMIAT) и Европейском (EMIAT) исследованиях у больных в постинфарктном периоде амиодарон не влиял на общую смертность больных, но достоверно уменьшал риск внезапной (аритмической) смерти (табл. 6).
По данным метаанализа АТМА, включившего в себя 13 основных исследований у больных с дисфункцией ЛЖ и/или сердечной недостаточностью, наряду со снижением аритмической смерти (на 29%) применение амиодарона все же сопровождалось уменьшением риска и общей смертности в среднем на 13% [11].
Однако связь этиологии ХСН с эффективностью этого препарата неоднозначна. Так, в исследовании CHF-STAT тенденция к снижению смертности на фоне терапии амиодароном отмечалась только у больных с неишемическим характером декомпенсации (20%, p=0,07); в то же время эффективность терапии больных ИБС приближалась к 0. В отличие от этой работы в аргентинском исследовании GESICA снижение риска смерти и/или госпитализации при применении амиодарона у больных ХСН составило в среднем 31%, но относительный “успех” имели уже больные с ИБС: снижение риска у них составило 38% против 23% у больных с кардиомиопатиями.
Антагонисты кальция
Эффективность применения антагонистов кальция у больных ХСН исследована недостаточно. Однако данные даже единичных работ дают противоречивые результаты. Исследование PRAISE I с амлодипином показало, что назначение этого препарата (на фоне иАПФ, диуретиков, гликозидов) сопровождается недостоверным снижением фатальных и нефатальных осложнений, а также частоты смертельных исходов в среднем на 9%. Причем этот “успех” был достигнут исключительно “благодаря” больным с ХСН неишемической этиологии (ДКМП, гипертоническое сердце и т.п.), у которых снижение риска смерти, ассоциированное с амлодипином, составило 46%; в то же время у больных ИБС этот показатель практически не менялся (табл. 7).
Прямо противоположные результаты были получены в исследовании V-HeFT-III с антагонистом кальция III поколения фелодипином: при ХСН у больных ИБС отмечалось снижение смертности в среднем на 18%; в то же время в подгруппе пациентов без ИБС число смертельных исходов на фоне этой терапии даже несколько превысило показатели в контрольной группе.
Заключение
Ближайшие и отдаленные тенденции в развитии сердечно-сосудистых заболеваний свидетельствуют, что рост числа больных ИБС сохранится и ХСН, как осложнение ИБС, в следующем веке станет одной из главных причин госпитализаций и смертности населения, особенно в старшей возрастной группе. В этой связи возникает вопрос: существуют ли надежные способы профилактики и лечения этого синдрома?
Анализ основных многоцентровых исследований не дает однозначного ответа: эффективность лечения пациентов ХСН при ИБС нередко бывает хуже, чем больных с декомпенсацией неишемической этиологии, например при ДКМП.
Причины этого явления могут быть связаны с “двойным” патогенезом ХСН при окклюзивном поражении коронарных артерий, который требует воздействия не только на процессы ремоделирования сердца, но и эффективного восстановления перфузии миокарда. Отсюда можно предположить, что без адекватной реваскуляризации сердечной мышцы трудно добиться успеха в предупреждении и лечении недостаточности кровообращения у больных с коронарным атеросклерозом. К сожалению, серьезных подтверждений этой концепции пока нет, поскольку больные с симптомами сердечной недостаточности, как правило, исключаются из исследований по реваскуляризации миокарда. Отдельные работы, проведенные с больными без выраженной дисфункции миокарда, показывают, что при 3—11% операционной летальности, 5-летняя выживаемость оперированных пациентов относительно удовлетворительная, но не лучше (а возможно, и хуже), чем у тех, кто получал адекватную медикаментозную терапию [1]. Безусловно, эти выводы не могут быть окончательными, поскольку решение вопроса об эффективности хирургических методов лечения таких больных требует проведения специально организованных исследований.
Необходимость “сосудистого коронарного” воздействия на больных ХСН ишемической этиологии получила неожиданное подтверждение при исследовании эффектов гиполипидемических препаратов (статинов) у больных с дислипопротеидемией и ИБС. Так, в исследовании CARE применение правастатина снижало частоту повторных инфарктов и смертности у больных с асимптоматической дисфункцией ЛЖ, а симвастатин в исследовании 4S вообще предупреждал развитие сердечной недостаточности [1]. Результаты этих исследований наводят на мысль, что если ингибиторы АПФ могут стать важным средством лечения больных ИБС, то статины — необходимым компонентом терапии больных ХСН ишемической этиологии.
Таким образом, сердечная недостаточность у больных с ИБС в настоящее время остается серьезной проблемой, решение которой возможно лишь при объединении усилий эпидемиологов и терапевтов, кардиологов и кардиохирургов, направленных как на профилактику и лечение коронарной болезни, так и на устранение ее осложнений — дисфункции желудочков и сердечной недостаточности.
Литература
1. Cleland J.F.G., McGowan J. Heart Failure due to Ischaemic Heart Disease: Epidemiology, Pathophysiology and Progression. J Cardiovasc Pharmacol 1999; 33 (suppl. 3): S17—S29.
2. Ю.Н.Беленков, В.Ю.Мареев, Ф.Т.Агеев. Медикаментозные пути улучшения прогноза больных хронической сердечной недостаточностью. М., “Инсайт”, 1997.
3. Kober L., Torp Pedersen., Carlsen J.E. et al. A clinical trial of the angio-converting-enzyme inhibitor trandolapril in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 1995; 333: 1670—6.
4. Effects of enalapril on survival in patients with reduced left ventricular ejection fraction and congestive heart failure. The SOLVD investigators. N Engl J Med. 1991; 325: 293—302.
5. The Digitalis Investigation Group. The effect of Digoxin on mortality and morbidity in patients with heart failure. N Engl J Med 1997; 336: 525—33.
6. Cashin-Hemphill L, Dinsmore RE, Chan RC et al. Atherosclerosis progression in subjects with and without post-angioplasty restenosis in QUIET. J am Coll Cardiol 1997; 29 (suppl. A): 418A.
7. Garg R, Yusuf S. Overview of randomized trial of angiotensin-converting enzyme inhibitors on mortality and morbidity in patients with heart failure. JAMA 1995; 1450—6.
8. MERIT-HF Study Group. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomized Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet 1999; 353: 2001—07.
9. Julian DG, Camm AJ, Frangin G. Et al. Randomozed trial of effect of amiodarone on mortality in patients with left-ventricular dysfunction after recent myocardial infarction: EMIAT. Lancet 1997; 349: 667—74.
10. Cairns JA, Connolly SJ, Roberts R. Et al. Randomozed trial of outcome after myocardial infarction in patient with frequent or repetitive premature depolarisation: CAMIAT. Lancet 1997; 349: 675—82.
11. Amiodaron Trials Meta-Analisis (ATMA). Lancet 1997; 350: 1417—24.
ИБС является основной этиологической причиной развития сердечной недостаточности.
Рис. 1. Риск развития ИМ (данные многоцентровых, плацебо-контролируемых исследований с различными ингибиторами АПФ).
Рис. 2. Абсолютное число спасенных жизней на 1000 пролеченных b-блокаторами больных, перенесших инфаркт миокарда. Зависимость эффекта от наличия или отсутствия сопутствующей сердечной недостаточности.
Тимолол — Норвежское исследование с тимололом;
ВНАТ — исследование с пропранололом;
Гётеборг — исследование с метопрололом (1).
Источник
ИБС— это группа
острых и хронических заболеваний
сердечной мышцы, морфологической основой
которой являетсяатеросклероз
коронарных артерий.В патофизиологической
основе болезни лежит несоответствие
между потребностью сердца в кровоснабжении
и реальной доставкой крови к сердцу.
Это несоответствие возникает не только
из-за атеросклеротического сужения
просвета коронарных сосудов, но также
из-за развития тромбоцитарных агрегатов
в этих сосудах, периодического спазма
(сужения) сосудов.
Классификация ишемической болезни сердца
(ВКНЦ
Амн СССР, 1983г. На основе предложений
экспертов ВОЗ (1979г.).
Внезапная коронарная
смерть (первичная остановка сердца).Стенокардия.
Стенокардия
напряжения.впервые возникшая
стенокардия напряжения,стабильная
стенокардия напряжения (с указанием
функционального класса от IдоIV),прогрессирующая
стенокардия напряжения.
Спонтанная, или
вариантная стенокардия (Принцметала).
Инфаркт миокарда:
крупноочаговый
(трансмуральный),
мелкоочаговый
(нетрансмуральный),
Постинфарктный
кардиосклероз (с указанием даты
перенесенного инфаркта).Нарушения сердечного
ритма (с указанием формы).Сердечная
недостаточность (с указанием стадии и
формы).«Немая» форма
ИБС.
СТЕНОКАРДИЯ
Стенокардия
– своеобразный приступообразный болевой
синдром, чаще всего возникающий за
грудиной или слева от грудины на фоне
атеросклероза или ангиоспазма коронарных
артерий. Патофизиологической основой
болевого синдрома является ишемия
миокарда.
Как
видно из представленной классификации
ИБС (таблица 9), стенокардия делится на
стенокардию
напряжения
и спонтанную
стенокардию.
В свою очередь стенокардия напряжения
делится на впервые возникшую стенокардию
напряжения, стабильную стенокардию
напряжения и прогрессирующую стенокардию
напряжения. Клинически наиболее
распространенной является стабильная
стенокардия напряжения.
О впервые
возникшей стенокардии напряженияговорят в тех случаях, когда с момента
возникновения первого приступа прошло
не более одного месяца.
Стабильная стенокардия напряжения
Жалобы: Основная
жалоба – типичная больза грудинойили слева от нее. Она приступообразная,
чаще всегодавящаяилисжимающая,
сопровождается чувством страха смерти.
Длительность боли3-5 минут, реже
15-20 минут, часто иррадиирует в левое
плечо, левую руку, лопатку, реже в шею,
нижнюю челюсть, межлопаточное пространство,
иногда в эпигастральную область (рис.
55),связана с физической нагрузкой,
подъемом артериального давления,
психоэмоциональным возбуждением. Она
прекращается (уменьшается) при прекращении
физической нагрузки или сразу же после
приема нитроглицерина. Отличительной
диагностической особенностью стабильной
стенокардии напряжения является
стереотипность ее течения, все приступы
похожи друг на друга, возникают только
при определенной физической нагрузке.
В связи с этим больные, зная все эти
нюансы, адаптируются к своему состоянию
и, регулируя уровень физической нагрузки
или принимая превентивно нитроглицерин
перед такими нагрузками, предупреждают
приступы стенокардии.
Осмотр: при
интенсивных болях кожные покровы
бледные, отмечается потливость, особенно
кожи лба. Больные ведут себя спокойно,
стараются «затаиться», характерна
вынужденная адинамия. На улице больные
останавливаются и, чтобы скрыть свое
состояние, делают вид, что рассматривают
витрины («симптом витрины»). Часто во
время приступа больные кладут сжатый
кулак на область сердца («симптом
кулака»). При хронической ИБС больные
постоянно ощущают боли в области большой
грудной мышцы слева («симптом орденской
колодки»).
Пальпация:
повышение болевой чувствительности в
зонах Захарьина-Геда, которая может
сохраняться в течение нескольких часов
после исчезновения болевого приступа.
Перкуссия сердца:
границы сердца не изменены (если нет
артериальной гипертензии и выраженного
кардиосклероза), часто расширен сосудистый
пучок воIIмежреберье.Аускультация сердца: в момент
приступа стенокардии —приглушение
первого тонана верхушке, часто
акцентIIтона на аорте,
появление аритмий (чаще экстрасистолии).
Нередко наблюдается урежение пульса и
повышение артериального давления.
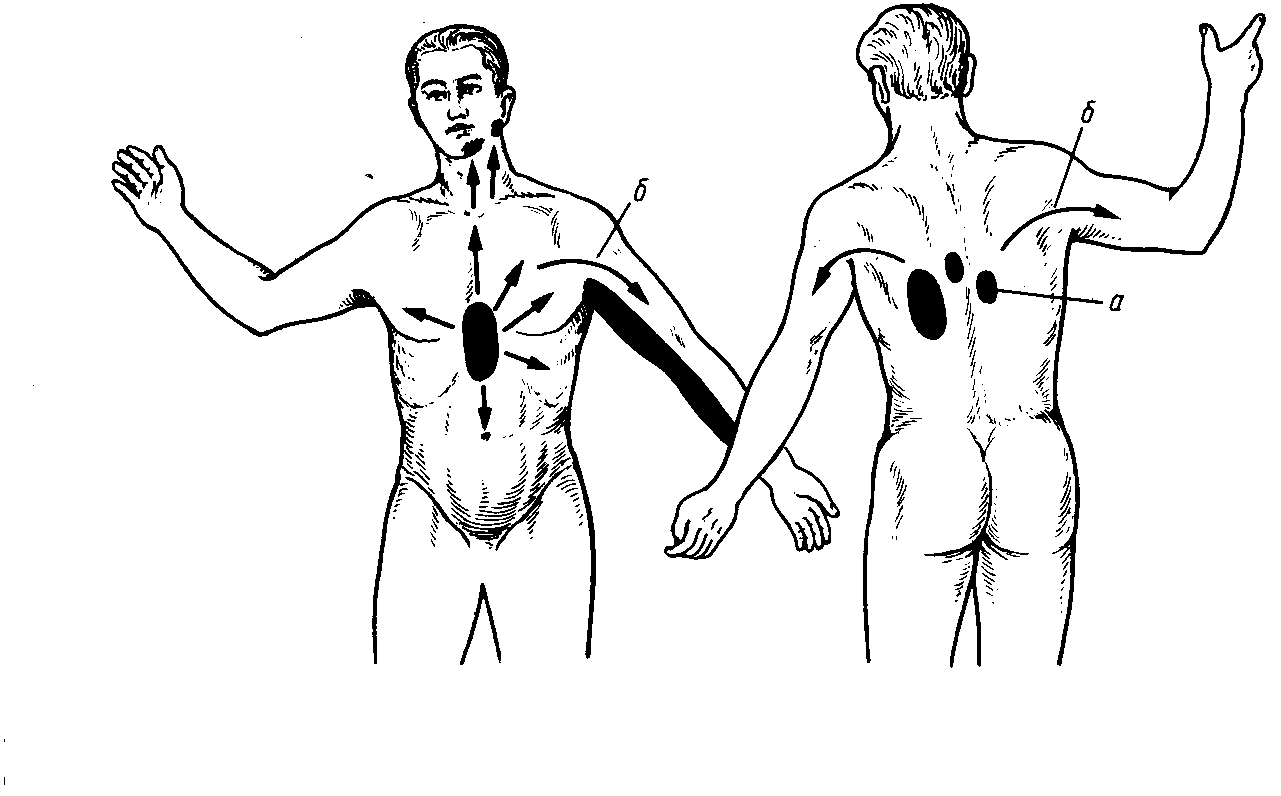
Рис.55. Зоны
локализации и иррадиации болей при
стенокардии и инфаркте миокарда.
Электрокардиография.На ЭКГ,снятой во время приступа
стенокардии, могут определяться признаки
нарушения коронарного кровообращения:смещение интервала SТчаще вниз,
реже вверх от изолинии более чем на 1
мм. Менее специфичным является снижение,
сглаживание или появление отрицательного
зубца Т. У ряда больных зубец Т становится
высоким, остроконечным. Эти изменения
не во всех отведениях, а чаще только в
1, II, V4-6илиIII,IIAVFотведениях, исчезают
спустя несколько минут (реже – часов)
после прекращения приступа.
Вне приступа на
ЭКГ в покое изменений может не быть.
Поэтому с целью постановки диагноза
применяются проба с физической нагрузкой
(велоэргометрическая), медикаментозные
пробы (дипиридамоловая, эргометриновая
проба),холтеровское мониторирование
(непрерывная запись ЭКГ в течение 24
часов).В зависимости от тяжести течения
стабильная стенокардия напряжения
делится на 4 функциональных класса.
Функциональный класс отражает
интенсивность (величину) физической
нагрузки, при которой возникает приступ
болей.
I
класс. Больной хорошо переносит
обычные физические нагрузки. Приступы
стенокардии возникают только при
нагрузке высокой интенсивности. Мощность
пороговой погрузки составляет 125 Вт и
более, определяемой с помощью ВЭП.
II
класс.Небольшое ограничение обычной
физической активности. Приступы
стенокардии возникают при ходьбе по
ровному месту на расстояние более 500
метров, при подъеме более чем на один
этаж. Мощность пороговой нагрузки
составляет 75-100 Вт.
III
класс.Выраженное ограничение
физической активности. Приступы возникают
при ходьбе в нормальном темпе по ровному
месту на расстояние от 100 до 500 метров и
при подъеме на один этаж. Мощность
пороговой нагрузки составляет 50 Вт.
IV
класс. Стенокардия возникает при
небольших физических нагрузках, ходьбе
по ровному месту на расстояние менее
100 метров. Характерно возникновение
приступов стенокардии и в покое,
обусловленное повышением метаболических
потребностей миокарда. Мощность пороговой
нагрузки составляет 25 Вт и менее.
Критериями
диагностики прогрессирующей стенокардии
являются учащение и утяжеление приступов
стенокардии, увеличение кратности
приема нитроглицерина и снижение его
эффективности, ухудшение общего состояния
больного, значительные и длительные
изменения на ЭКГ (очаговая депрессия
сегмента ST, появление
отрицательных зубцов Т, различных
нарушений ритма сердца).
Стресс-эхокардиография.
Этод метод является более точным для
выявления недостаточности венечных
артерий. Суть его заключается в
эхокардиографической оценке подвижности
сегментов левого желудочка при увеличении
ЧСС в результате введения добутамика,
чреспищеводной электрокардиостимуляции
или под влиянием физической нагрузки.
При учащении сердечного ритма повышается
потребность миокарда в кислороде и
возникает дисбаланс между доставкой
кислорода по суженным венечным артериям
и потребностью в нем определенного
участка миокарда. При этом возникают
локальные нарушения сократимости
миокарда, подвижность ишемизированного
участка уменьшается. Изменения локальной
сократимости миокарда предшествуют
другим проявлениям ишемии (болевому
синдрому, изменениям ЭКГ).
С целью наиболее
точной верификации коронарного
атеросклероза одним из наиболее
достоверных методов является
коронарография. Данный метод
считают «золотым стандартом» в диагностике
ИБС, поскольку позволяет выявить наличие,
локализацию и степень сужения венечных
артерий.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
