Жэ тем что это за болезнь
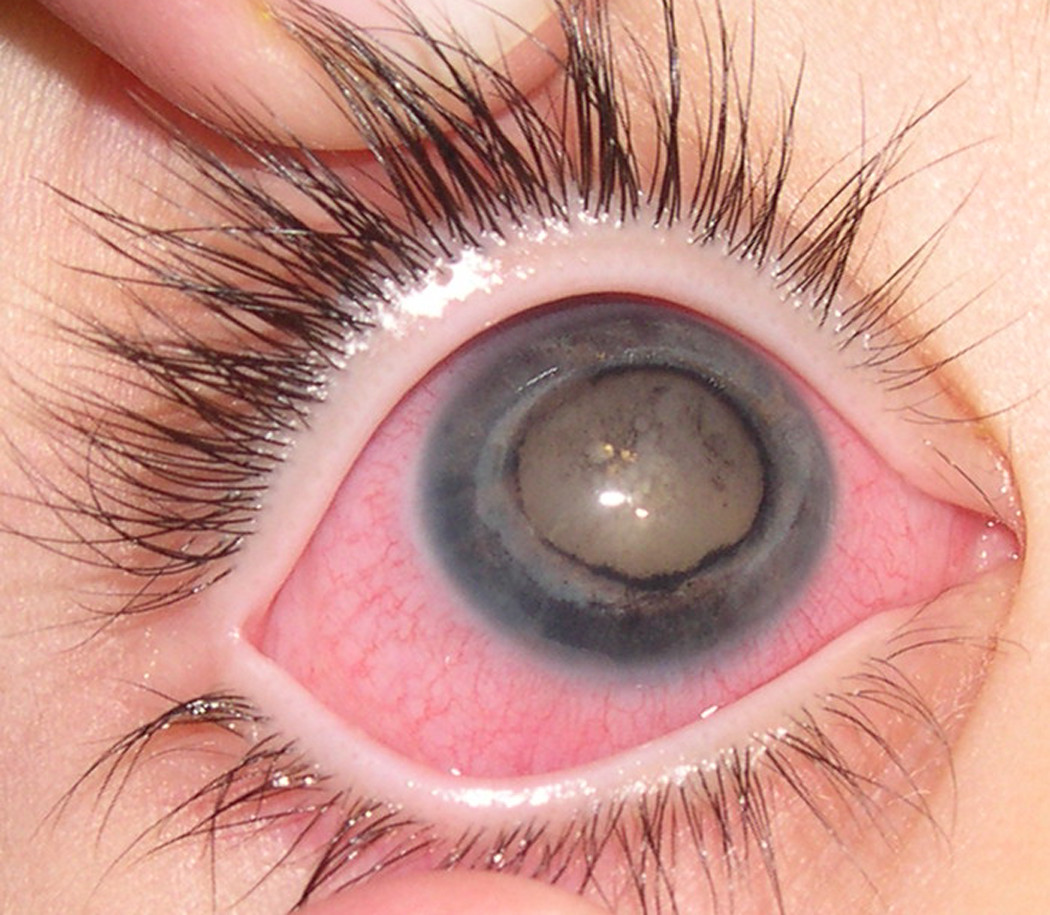
Болезнь Коутса (также известная как экссудативный ретинит или телеангиэктазия сетчатки) — очень редкое врождённое ненаследственное заболевание глаз, вызывающее полную или частичную слепоту и характеризующееся аномальным развитием кровеносных сосудов позади сетчатки. Болезнь Коутса также может вызывать глаукому. Может выглядеть как ретинобластома[3].
Представление[править | править код]
Болезнь Коутса, как правило, влияет только на один глаз (односторонняя) и происходит преимущественно у молодых мужчин 1/100 000, симптомы обычно появляются в первой декаде жизни. Пик возраста начала между 6-8 лет, но начало может варьироваться от 5 месяцев до 71 лет[4][5].
Болезнь Коутса приводит к постепенной потере зрения. Происходит утечка крови из аномальных сосудов в задней части глаза, оставляющая сзади холестериновые отложения и повреждающая сетчатку. Болезнь Коутса обычно прогрессирует медленно. В поздних стадиях может произойти отслоение сетчатки. Глаукома, атрофия и катаракта могут развиваться в качестве вторичного процесса к болезни Коутса. В некоторых случаях может понадобиться удаление глаза (энуклеация).
Признаки и симптомы[править | править код]
Наиболее распространённым видимым признаком является лейкокория (аномальный белый рефлекс сетчатки)[4]. Симптомы обычно начинаются с затуманенного зрения, ярко выраженного, когда один глаз закрыт (из-за одностороннего характера заболевания). Обычно здоровый глаз компенсирует потери зрения в другом глазу; однако это приводит к некоторой потере восприятия глубины и параллаксу. Ухудшение зрения может начаться либо с центральной, либо с периферической области. Ухудшение может начаться в верхней части поля зрения, так как это соответствует нижней части глаза, где кровь обычно скапливается. Вспышки света, известные как фотопсия, и деструкция стекловидного тела — общие симптомы. Постоянные цветные узоры могут восприниматься поражённым глазом, которые вначале могут быть ошибочно приняты за психологические галлюцинации, но на самом деле являются результатом отслоения сетчатки и действия посторонних жидкостей, механически взаимодействующих с фоторецепторами, расположенными в сетчатке.
Одним из первых предупреждающих симптомов болезни Коутса является «жёлтый глаз» при съёмке со вспышкой. Так же, как эффект красных глаз, который вызван отражением от кровеносных сосудов в задней части нормального глаза, глаз, пострадавших от болезни Коутса, будет светиться жёлтым на фотографии, так как свет отражается от отложений холестерина. Детям с жёлтым глазом на фотографиях, как правило, рекомендуется немедленно пройти обследование у офтальмолога, который оценит и диагностирует состояние, и обратиться к витреоретинальному специалисту.
Маленький ребёнок с жёлтым глазом от болезни Коутса — ещё на ранней стадии. Видно только с флеш-камеры
Болезнь Коутса сама по себе безболезненна. Боль может возникнуть, если жидкость не может вытечь из глаза должным образом, вызывая рост внутреннего давления, порождая болезненную глаукому.
Патогенез[править | править код]
Болезнь Коутса, как полагают, результат распада гемато-ретинального барьера эндотелиальных клеток, в результате происходит утечка продуктов крови, содержащих холестериновые кристаллы и липидосодержащих макрофагов в сетчатку и субретинальное пространство. Со временем накопление этого белкового экссудата утолщает сетчатку, что приводит к массовому, экссудативному отслоению сетчатки[4][6].
Диагностика[править | править код]
При осмотре глазного дна, сосуды сетчатки в начале болезни Коутса просматриваются извилистые и расширенные, в основном приуроченные к периферийным и височным участкам сетчатки[4]. В средней и тяжёлой стадии болезни Коутса видно массивное отслоение сетчатки и кровоизлияния из аномальных сосудов[4][7].
Результаты визуализации[править | править код]
Компьютерная томография пациента с болезнью Коутса, показывает общее экссудативное отслоение сетчатки в правом глазу.
Визуализирующие исследования, такие как ультразвуковое исследование (УЗИ), компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) могут помочь диагностике. На УЗИ, болезнь Коутса выглядит как гиперэхогенная масса в задней части стекловидного тела без задней акустической тени; также наблюдаются кровоизлияния в стекловидное тело и субретинальную область[8][9].
На КТ, гиперплотный шар появляется на фоне обычного стекловидного тела из-за белкового экссудата, который может уничтожить стекловидное тело на поздних стадиях заболевания. Передний край субретинального экссудата усиливается с контрастом. Поскольку сетчатка фиксируется сзади оптического диска, это усиление имеет V-образную конфигурацию[4].
На МРТ, субретинальный экссудат показывает высокую интенсивность сигнала как на Т1 так и на Т2-взвешенных изображениях. Экссудат может показаться гетерогенным при наличии кровотечения или фиброза. Субретинальная пространство не увеличивается гадолиниевыми контрастными агентами. От лёгкого до умеренного линейное усиление видно между экссудатом и остальной частью стекловидного тела. В 1H-ЯМР спектре экссудата наблюдается большой пик при 1—1,6 ppm[10].
Патологические результаты[править | править код]
Случай болезни Коутса, показывающий общее отслоение сетчатки с субретинальным эссудатом, содержащим кристаллы холестерина и фиброзные узелки в заднем полюсе.
Как правило, макроскопически видны отслоение сетчатки и желтоватый субретинальный экссудат, содержащий кристаллы холестерина.
Случай болезни Коутса, показывающий общее отслоение сетчатки с субретинальным эссудатом, содержащим кристаллы холестерина (H&E).
Микроскопически, стенки сосудов сетчатки могут утолщаться в некоторых случаях, в то время как в других случаях стенки может быть истончены с нерегулярным расширением просветов[11]. Субретинальный экссудат состоит из кристаллов холестерина, макрофагов, нагруженных холестерином и пигментом, эритроцитов, и гемосидерина[12]. Гранулематозную реакцию, индуцированную экссудатом, может быть видно в сетчатке[13]. Фрагменты сетчатки могут развивать глиоз в ответ на повреждение.
Лечение[править | править код]
На ранних стадиях, существует несколько вариантов лечения. Лазерная хирургия или криотерапия (замораживание) может использоваться для уничтожения аномальных кровеносных сосудов, тем самым останавливая прогрессирование заболевания. Тем не менее, если утечка кровеносных сосудов группируется вокруг зрительного нерва, это лечение не рекомендуется, так как случайное повреждение нерва само по себе может привести к постоянной слепоте. Хотя болезнь Коутса имеет тенденцию прогрессировать до потери зрения, прогрессирование может остановиться само по себе, временно или постоянно. Были зарегистрированы случаи, в которых состояние реверсировало само себя. Однако, если происходит общее отслоение сетчатки, в большинстве случаев зрение теряется постоянно. Удаление глаза (энуклеация) является вариантом, если возникает боль или дальнейшие осложнения.
История[править | править код]
Болезнь Коутса (Coats’ disease) названа в честь Джорджа Коутса[de][14][15].
Примечания[править | править код]
- ↑ Disease Ontology release 2019-05-13 — 2019-05-13 — 2019.
- ↑ Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
- ↑ Shields C.L., Uysal Y., Benevides R., Eagle R.C., Malloy B., Shields J.A. Retinoblastoma in an eye with features of Coats’ disease (англ.) // J Pediatr Ophthalmol Strabismus (англ.)русск. : journal. — 2006. — Vol. 43, no. 5. — P. 313—315. — PMID 17022167.
- ↑ 1 2 3 4 5 6 EdwardDP, Mafee MF, Garcia-Valenzuela E, Weiss RA. Coats’ disease and persistent hyperplastic primary vitreous: role of MR imaging and CT. Radiol Clin North Am 1998; 36(6): 1119—1131.
- ↑ WoodsAC, Duke JR. Coats’s disease. I. Review of the literature, diagnostic criteria, clinical findings, and plasma lipid studies. Br J Ophthalmol 1963; 47: 385—412.
- ↑ ChangMM, McLean IW, Merritt JC. Coats’ disease: a study of 62 histologically confirmed cases. J Pediatr Ophthalmol Strabismus 1984; 21(5): 163—168.
- ↑ ShieldsJA, Shields CL. Review: Coats disease—the 2001 LuEsther T. Mertz lecture. Retina 2002; 22(1): 80-91.
- ↑ BerrocalT, de Orbe A, Prieto C, et al. US and color Doppler imaging of ocular and orbital disease in the pediatric age group. RadioGraphics 1996; 16(2): 251—272.
- ↑ GlasierCM, Brodsky MC, Leithiser RE Jr, Williamson SL, Seibert JJ. High resolution ultrasound with Doppler: a diagnostic adjunct in orbital and ocular lesions in children. Pediatr Radiol 1992; 22(3): 174—178.
- ↑ EisenbergL, Castillo M, Kwock L, Mukherji SK, Wallace DK. Proton MR spectroscopy in Coats disease. AJNR Am J Neuroradiol 1997; 18(4): 727—729.
- ↑ Chung EM, Specht CS, Schroeder JW. Pediatric Orbit Tumors and Turmorlike Lesions: Neuroepthelial Lesions of the Ocular Globe and Optic Nerve. Radiographics. 2007 Jul-Aug;27(4):1159-86.
- ↑ KremerI, Nissenkorn I, Ben-Sira I. Cytologic and biochemical examination of the subretinal fluid in diagnosis of Coats’ disease. Acta Ophthalmol (Copenh) 1989; 67(3): 342—346.
- ↑ FernandesBF, Odashiro AN, Maloney S, Zajdenweber ME, Lopes AG, Burnier MN Jr. Clinical-histopathological correlation in a case of Coats’ disease. Diagn Pathol 2006; 1: 24.
- ↑ synd/2146 на Who Named It?
- ↑ G. Coats. Forms of retinal disease with massive exudation. Royal London Ophthalmic Hospital Reports, 1908, 17, 3: 440—525.
Ссылки[править | править код]
- GeneReviews/NIH/NCBI/UW entry on NDP-Related Retinopathies (англ.)
Источник
У этого термина существуют и другие значения, см. БАС (значения).
Боково́й (латера́льный) амиотрофи́ческий склеро́з (БАС; также известен как боле́знь мото́рных нейро́нов, мотонейро́нная боле́знь, боле́знь Шарко́, в англоязычных странах — болезнь Лу Ге́рига [англ. Lou Gehrig’s disease]) — прогрессирующее, неизлечимое дегенеративное заболевание центральной нервной системы, при котором происходит поражение как верхних (моторная кора головного мозга), так и нижних (передние рога спинного мозга и ядра черепных нервов) двигательных нейронов, что приводит к параличам и последующей атрофии мышц.
Характеризуется прогрессирующим поражением двигательных нейронов, сопровождаемым параличом (парезом) конечностей и атрофией мышц. Смерть наступает от инфекций дыхательных путей или отказа дыхательной мускулатуры. Боковой амиотрофический склероз следует отличать от синдрома БАС, который может сопровождать такие заболевания, как клещевой энцефалит.
Болезнь впервые описана в 1869 году Жан-Мартеном Шарко.
На международном уровне показатели заболеваемости боковым амиотрофическим склерозом (amyotrophic lateral sclerosis, ALS) или заболеванием двигательных нейронов (motor neurone disease, MND) по всему миру оцениваются в диапазоне от 0,86 до 2,5 на 100 тысяч человек в год[3], то есть БАС является редким заболеванием.
Этиология[править | править код]
Точная этиология БАС неизвестна. Примерно в 5% случаев встречаются семейные (наследственные) формы заболевания. 20% семейных случаев БАС связаны с мутациями гена супероксиддисмутазы-1, расположенного в 21-й хромосоме[4][5]. Как полагают, этот дефект наследуется аутосомно-доминантно.
В патогенезе заболевания ключевую роль играет повышенная активность глутаматергической системы, при этом избыток глутаминовой кислоты вызывает перевозбуждение и гибель нейронов (т. н. эксайтотоксичность). Сохранившиеся мотонейроны могут спонтанно деполяризироваться, что клинически выявляется фасцикуляциями.
Учёные из Университета Джонса Хопкинса в Балтиморе установили молекулярно-генетический механизм, лежащий в основе возникновения данного заболевания. Он связан с появлением в клетках большого количества четырёхспиральной ДНК и РНК в гене C9orf72, что приводит к нарушению процесса транскрипции, а, следовательно, и синтеза белка. Однако, вопрос о том, как именно эти изменения ведут к деградации мотонейронов, остаётся открытым[6].
Также важное значение в патофизиологии имеет TDP-43, который был определен как основной компонент убиквитинированных цитоплазматических белковых агрегатов у всех пациентов со спорадическим БАС, но расположенный вне ядра (в нормальных нейронах он находится в ядре). Несмотря на то, что вопрос того, являются ли данные агрегаты причиной нейродеградации при БАС, остается открытым, мутации в TARDBP были обнаружены всего лишь в 3 % случаях наследственной формы склероза и у 1,5 % пациентов со спорадическим БАС, позволяя предположить, что агрегаты TDP-43 играют ключевую роль в инициации БАС. Помимо мутаций в гене TARDBP ионы цинка также могут вызывать агрегацию TDP-43[7][8].
Обнаружение мутаций гена FUS (Fusion in Sarcoma — ген «слияния в саркоме») в 16-й хромосоме, которые связаны с наследственными формами БАС, поддерживает данную теорию. Агрегаты FUS не были явно определены у пациентов с патологическими изменениями в TDP-43 или SOD1, что указывает на новый путь возникновения болезни.
Факторы риска[править | править код]
На БАС приходится примерно 3% всех органических поражений нервной системы. Болезнь обычно развивается начиная с возраста 30—50 лет[9][10].
Суммарный риск получить БАС в течение жизни составляет 1:400 для женщин и 1:350 для мужчин.
5—10 % заболевших — носители наследственной формы БАС; на тихоокеанском острове Гуам выявлена особая, эндемичная форма заболевания. Абсолютное большинство случаев (90—95 %) не связаны с наследственностью и не могут быть положительно объяснены какими-либо внешними факторами (перенесёнными заболеваниями, травмами, экологической ситуацией и т. п.)[11].
Несколько научных исследований[12][13][14][15] нашли статистические корреляции между БАС и некоторыми сельскохозяйственными пестицидами.
Течение болезни[править | править код]
Ранние симптомы болезни: подёргивания, судороги, онемение мышц, слабость в конечностях, затруднение речи — также свойственны многим более распространённым заболеваниям, поэтому диагностика БАС затруднена — до тех пор, пока болезнь не развивается до стадии мышечной атрофии.
В редких случаях возможно наличие продромальной фазы, до 1 года, во время которой будут наблюдаться изолированные фасцикуляции и/или судороги.
В зависимости от того, какие части тела поражены в первую очередь, различают
- БАС конечностей (до трёх четвертей больных) начинается, как правило, с поражения одной или обеих ног. Больные чувствуют неловкость при ходьбе, негибкость в голеностопе, спотыкаются. Реже встречаются поражения верхних конечностей, при этом затруднено выполнение обычных действий, требующих гибкости пальцев или усилия кисти.
- Бульбарный БАС проявляется в затруднении речи (больной говорит «в нос», гнусавит, плохо управляет громкостью речи, в дальнейшем испытывает трудности с глотанием).
Во всех случаях мышечная слабость постепенно охватывает всё больше частей тела (больные бульбарной формой БАС могут не доживать до полного пареза конечностей). Симптомы БАС включают признаки поражения как нижних, так и верхних двигательных нервов:
- поражение верхних двигательных нейронов: гипертонус мышц, гиперрефлексия, аномальный рефлекс Бабинского.
- поражение нижних двигательных нейронов: слабость и атрофию мышц, судороги, непроизвольные фасцикуляции (подёргивания) мышц.
Рано или поздно больной теряет способность самостоятельно передвигаться. Болезнь не влияет на умственные способности, но приводит к тяжёлому состоянию в ожидании неминуемой смерти. На поздних этапах болезни поражается дыхательная мускулатура, больные испытывают перебои в дыхании, в конечном итоге их жизнь может поддерживаться только искусственной вентиляцией лёгких и искусственным питанием. Обычно от выявления первых признаков БАС до смерти проходит от трёх до пяти лет. Однако широко известный физик-теоретик Стивен Хокинг (1942-2018) и гитарист Джейсон Беккер (род. 1969) — единственные известные больные с однозначно диагностированным БАС, у которых состояние со временем стабилизировалось.
Симптомы[править | править код]
- слабость;
- мышечные спазмы;
- нарушения речи и глотания;
- нарушение равновесия;
- спастика;
- повышение глубоких рефлексов или расширение рефлексогенной зоны[16];
- патологические рефлексы;
- атрофия;
- зависание стопы;
- респираторные расстройства;
- приступы непроизвольного смеха или плача;
- депрессия.
Диагностика[править | править код]
Существует множество заболеваний, вызывающих те же симптомы, что и ранние стадии БАС. Диагностика заболевания возможна только методом исключения более распространённых заболеваний. Оба ключевых признака БАС (поражения и верхних, и нижних двигательных нейронов) проявляются на достаточно развитых стадиях болезни.
Международной федерацией неврологии (англ. World Federation of Neurology) разработаны Эль-Эскориальские критерии для постановки диагноза БАС[17]. Для этого необходимо наличие:
- признаков поражения центрального мотонейрона по клиническим данным
- признаков поражения периферического мотонейрона по клиническим, электрофизиологическим и патоморфологическим данным
- прогрессирующего распространения симптомов в пределах одной или нескольких областей иннервации, что выявляют при наблюдении за больным
При этом должны быть исключены другие причины данных симптомов.
Для электрофизиологического обследования используется электромиография, которая полезна в исследовании проводимости нервов и определении наличия признаков поражения периферического мотонейрона (потенциалы фибрилляций, потенциалы фасцикуляций, положительные острые волны и др).
Также важно дифференцировать фасцикуляции при БАС от фасцикуляций при синдроме доброкачественных фасцикуляций (англ. BFS), который зачастую диагностируется при наличии фасцикуляций и одновременном отсутствии объективной слабости и изменений на ЭМГ, и имеет чаще всего психологическую причину.
Второстепенными методами диагностики являются:
- МРТ головного и спинного мозга
- биохимический анализ крови (КФК, креатинин, общий белок, АЛС, АСТ, ЛДГ)
- клинический анализ крови
- исследование ликвора (белок, клеточный состав)
- серологические анализы (антитела к боррелиям, к ВИЧ)
- транскраниальная магнитная стимуляция (ТМС)
- биопсия мышцы или нерва
Возможные изменения при обследовании второстепенными методами диагностики:
- повышение КФК в 2-3 раза (у 50 % больных)
- незначительное повышение АЛТ, АСТ, ЛДГ
- выявление отмирания пирамидных путей на МРТ
- признаки атрофии и денервации при гистологическом исследовании
Лечение[править | править код]
Больным БАС требуется поддерживающая терапия для облегчения симптомов[18].
Постепенно у больных начинает ослабляться дыхательная мускулатура, развивается дыхательная недостаточность и становится необходимым применение оборудования для облегчения дыхания во время сна (IPPV или BIPAP). Затем, после полного отказа дыхательной мускулатуры, требуется круглосуточное использование аппарата искусственной вентиляции лёгких.[18]
Ведутся исследования по методу лечения, использующего блокировку генов, вызывающих это заболевание[19].
Замедление прогрессирования[править | править код]
Рилузол (рилутек) — единственный препарат, достоверно замедляющий прогрессирование БАС[20][21]. Доступен с 1995 года. Он ингибирует высвобождение глутамата, тем самым уменьшая повреждение двигательных нейронов. Продлевает жизнь больных в среднем на месяц, немного отдаляет момент, когда больному потребуется искусственная вентиляция легких[22].
HAL-терапия, новый метод роботизированного лечения, официально допущен к применению в реабилитации БАС в Европе и Японии[23].
В 2017 году для лечения БАС впервые за 22 года был одобрен новый препарат — Радикава (Эдаравон)[24].
Также проводятся клинические исследования по применению препарата Маситиниб[25].
В России[править | править код]
В Москве действуют:
- Благотворительный фонд помощи людям с БАС и другими нейромышечными заболеваниями «Живи сейчас»
- Благотворительный фонд помощи больным БАС Г. Н. Левицкого. https://www.alsportal.ru
- служба помощи больным БАС при АНО «Больница Святителя Алексия».
В то же время в России многим больным БАС не оказывается надлежащая медицинская помощь[26]. Например, до 2011 года БАС даже не был включен в список редких заболеваний, а единственный препарат, замедляющий течение болезни, Рилузол, не зарегистрирован[27].
Акции в поддержку[править | править код]
Летом 2014 года проходила популярная вирусная акция по повышению осведомлённости о заболевании и сбор средств, получившая название Ice Bucket Challenge или ALS Ice Bucket Challenge. Летом 2018 года акция прошла повторно для сбора средств на построение клиники по борьбе с заболеванием в Южной Корее.
См. также[править | править код]
- Супероксиддисмутаза-1 — фермент, связанный с частью случаев заболевания.
- Спинальная мышечная атрофия
Примечания[править | править код]
- ↑ Disease Ontology release 2019-05-13 — 2019-05-13 — 2019.
- ↑ Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
- ↑ Epidemiology of Sporadic ALS. (англ.) (недоступная ссылка). Stanford Medicine » School of Medicine. Дата обращения 24 октября 2015. Архивировано 8 октября 2015 года.
- ↑ Conwit, Robin A. Preventing familial ALS: A clinical trial may be feasible but is an efficacy trial warranted? (англ.) // Journal of the Neurological Sciences (англ.)русск. : journal. — 2006. — December (vol. 251, no. 1—2). — P. 1—2. — ISSN 0022-510X. — doi:10.1016/j.jns.2006.07.009. — PMID 17070848.
- ↑ Al-Chalabi, Ammar; P. Nigel Leigh. Recent advances in amyotrophic lateral sclerosis (англ.) // Current Opinion in Neurology (англ.)русск.. — Lippincott Williams & Wilkins (англ.)русск., 2000. — August (vol. 13, no. 4). — P. 397—405. — ISSN 1473-6551. — doi:10.1097/00019052-200008000-00006. — PMID 10970056.
- ↑ «Болезнь Хокинга» объяснили появлением четырехспиральной ДНК // Лента.ру, 2014-03-07
- ↑ Cyrille Garnier, François Devred, Deborah Byrne, Rémy Puppo, Andrei Yu. Roman. Zinc binding to RNA recognition motif of TDP-43 induces the formation of amyloid-like aggregates (En) // Scientific Reports. — 2017-07-28. — Т. 7, вып. 1. — ISSN 2045-2322. — doi:10.1038/s41598-017-07215-7.
- ↑ Aphrodite Caragounis, Katherine Ann Price, Cynthia P.W. Soon, Gulay Filiz, Colin L. Masters. Zinc induces depletion and aggregation of endogenous TDP-43 // Free Radical Biology and Medicine. — Т. 48, вып. 9. — С. 1152—1161. — doi:10.1016/j.freeradbiomed.2010.01.035.
- ↑ Хондкариан О. А., Боковой амиотрофический склероз, в кн.: Многотомное руководство по неврологии, под ред. С. Н. Давиденкова, т. 3, кн. 1, М., 1962
- ↑ Амиотрофический боковой склероз — статья из Большой советской энциклопедии.
- ↑ https://www.ninds.nih.gov/disorders/amyotrophiclateralsclerosis/detail_ALS.htm Архивная копия от 4 января 2015 на Wayback Machine «In 90 to 95 percent of all ALS cases, the disease occurs apparently at random with no clearly associated risk factors. … About 5 to 10 percent of all ALS cases are inherited. The familial form of ALS usually results from a pattern of inheritance that requires only one parent to carry the gene responsible for the disease. Mutations in more than a dozen genes have been found to cause familial ALS.»
- ↑ Exposure to pesticides and risk of amyotrophic lateral sclerosis: a population-based case-control study.By Bonvicini F, Marcello N, Mandrioli J, Pietrini V, Vinceti M. In Ann Ist Super Sanita. 2010; 46(3):284-7.PMID 20847462
- ↑ Pesticide exposure as a risk factor for amyotrophic lateral sclerosis: A meta-analysis of epidemiological studies: Pesticide exposure as a risk factor for ALS. By Malek AM, Barchowsky A, Bowser R, Youk A, Talbott EO. In Environ Res. 2012 Aug; 117:112-9. PMID 22819005
- ↑ Are environmental exposures to selenium, heavy metals, and pesticides risk factors for amyotrophic lateral sclerosis?. By Vinceti M, Bottecchi I, Fan A, Finkelstein Y, Mandrioli J. In Rev Environ Health. 2012; 27(1):19-41. PMID 22755265
- ↑ Pesticide exposure and amyotrophic lateral sclerosis. By Kamel F, Umbach DM, Bedlack RS, Richards M, Watson M, Alavanja MC, Blair A, Hoppin JA, Schmidt S, Sandler DP. In Neurotoxicology. 2012 Jun; 33(3):457-62. PMID 22521219
- ↑ Рефлексогенные зоны — статья из Большой советской энциклопедии.
- ↑ Brooks B.R., Miller R.G., Swash M., Munsat T.L. El Escorial revisited: revised criteria for the diagnosis of amyotrophic lateral sclerosis (англ.) // Amyotroph. Lateral Scler. Other Motor Neuron Disord. : journal. — 2000. — December (vol. 1, no. 5). — P. 293—299. — PMID 11464847.
- ↑ 1 2 https://www.ninds.nih.gov/disorders/amyotrophiclateralsclerosis/detail_ALS.htm Архивная копия от 4 января 2015 на Wayback Machine How is ALS treated?
- ↑ Эрон Гитлер, Леонард Петручелли. Разгадка тайны БАС // В мире науки. — 2017. — № 8/9. — С. 50—56.
- ↑ Неврология. Национальное руководство. — ГЭОТАР-Медиа, 2010. — 2116 с. — 2000 экз. — ISBN 978-5-9704-0665-6.
- ↑ Riluzole // PATIENT & CAREGIVER EDUCATION (рус.)
- ↑ https://www.ninds.nih.gov/disorders/amyotrophiclateralsclerosis/detail_ALS.htm Архивная копия от 4 января 2015 на Wayback Machine However, the Food and Drug Administration (FDA) approved the first drug treatment for the disease—riluzole (Rilutek)—in 1995. Riluzole is believed to reduce damage to motor neurons by decreasing the release of glutamate. Clinical trials with ALS patients showed that riluzole prolongs survival by several months
- ↑ Nagata, Kazuaki. Japan recognizes Cyberdyne’s robotic suit as medical device, widespread use anticipated (англ.), The Japan Times Online (26 November 2015). Дата обращения 10 февраля 2016.
- ↑ https://mosmedpreparaty.ru/news/4923
- ↑ https://www.ab-science.com/file_bdd/content/1490200983_SLAPresentationv03.2017vdef.pdf
- ↑ Епископ РОСХВЕ просит главу Минздрава РФ изменить ситуацию с отношением к больным «непризнанным» недугом, NewsRu, 21 августа 2013
- ↑ Где взять право на надежду? // «Честное слово» № 3 (832), 23.01.2013
Ссылки[править | править код]
- National Amyotrophic Lateral Sclerosis (ALS) Registry // CDC, США (англ.)
- ALS Therapy Development Institute (англ.)
- Информационный портал о БАС www.als-info.ru
- боковой амиотрофический склероз.рф // Инга Видус
Источник
