Понятие о болезнях с нетрадиционным наследованием
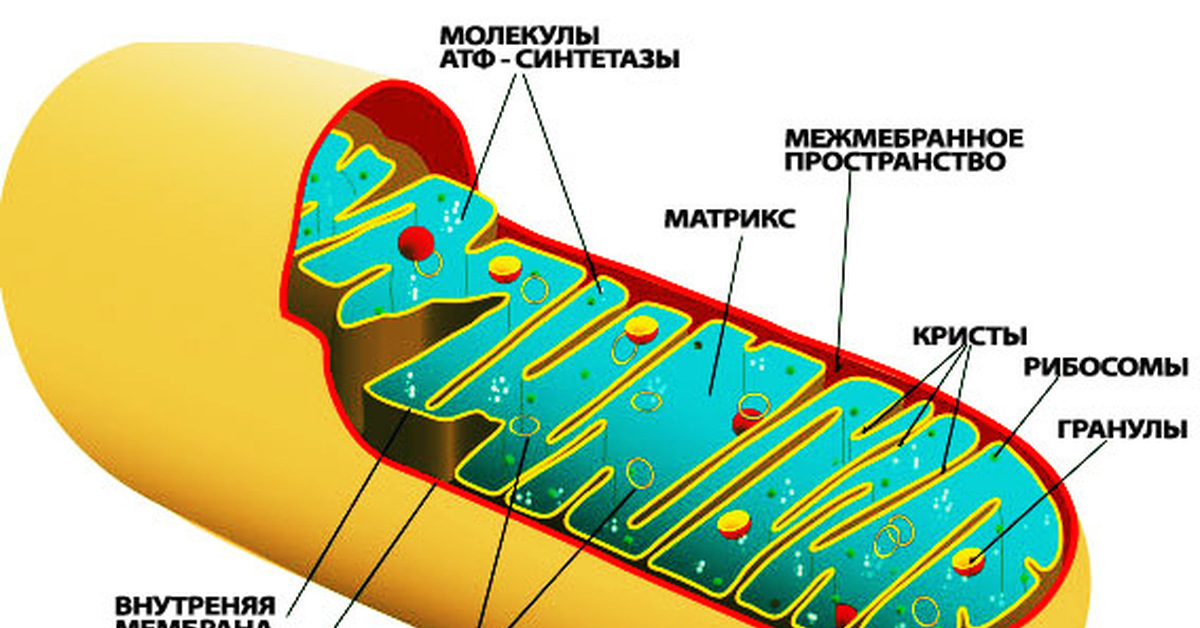
К болезням с нетрадиционным типом наследования относят такие феномены как митохондриальные болезни, геномный импринтинг, однородительские дисомии, экспансия тринуклеотидных повторов.
- Митохондриальные болезни. — наследуются по материнской линии.
Наследование признаков, передаваемых через ДНК митохондрий, и связь мутаций митохондриальной ДНК с болезнями человека было впервые показано в 1988 году. С тех пор обнаружено большое число мутаций мтДНК, лежащих в основе целого ряда нейродегенеративных заболеваний, некоторых МФЗ, митохондриальных миопатий.
Примеры:
- наследственная нейроофтальмия Лебера (характеризуется билатеральной потерей зрения).
- синдром MERRF (характеризуется прогрессирующей дегенерацией нервной и мышечной ткани, что проявляется судорогами, атаксией, миопатией, потерей слуха).
- летальная инфантильная дыхательная недостаточность и др.
- Болезни экспансии тринуклеотидных повторов.
Это новый класс наследственных болезней, в основе развития которых лежит единый механизм – динамическая мутация, которая представляет собой разное возрастание (экспансия) числа копий тринуклеотидных повторов в последующих поколениях родословной, и сопровождается возникновением заболевания при превышении некоторого порогового числа этих повторов.
Общие характеристики этого класса болезней следующие:
— Болезни с экспансией тринуклеотидных повторов представляют собой нейродегенеративные заболевания с поздним проявлением.
— Отмечается прямая корреляция между числом тринуклеотидных повторов и тяжестью клинической картины.
— Для болезней экспансии характерна генетическая антиципация – возрастание тяжести заболевания в последующих поколениях, что связано с тенденцией к возрастанию числа повторов у потомков.
Первое заболевание, при исследовании которого в 1991 году был открыт феномен экспансии – синдром фрагильной (ломкой) Х-хромосомы, или синдром Мартин-Белл. Проявления: умственная отсталость, аутизм, макроорхидизм (у взрослых), удлиненное лицо, прогнатия, оттопыренные уши, пронзительная смешная речь, аномалии соединительной ткани, нарушение поведения.
Сейчас открыта целая группа болезней с экспансией тринуклеотидных повторов.
- Болезни геномного импринтинга и однородительские дисомии.
Под геномным импринтингом понимают эпигенетический процесс, который дифференциально маркирует материнские и отцовские гомологичные хромосомы, что приводит к разному фенотипическому проявлению мутаций у потомства, унаследованных от матери или отца. В участках генома, подверженных импринтингу, экспрессируется только один из двух аллелей – отцовский или материнский, т.е. наблюдается моноаллельная экспрессия генов. Второй аллель, вследствие наличия на нем некоего отпечатка, импринтирован (выключен или подавлен) и не экспрессируется. Такой способ регуляции генов свидетельствует о неэквивалентном вкладе родителей в геном потомков.
Явление геномного импринтинга можно отчетливо представить при разборе другого явления – однородительские дисомии (недавно открытого).
У индивидов с однородительскими дисомиями нормальное число хромосом по всем парам. Однако, одна пара представлена хромосомами от одного и того же родителя.Происходит это следующим образом:возникшая в процессе гаметогенеза дисомия в гамете по определенной хромосоме за счет нерасхождения хромосом при оплодотворении приводит к трисомии. По неясным пока причинам третья хромосома может элиминироваться на ранних стадиях дробления, а у зародыша останутся две хромосомы одного родителя.
Пример:известно, что в проксимальном участке хромосомы 15 имеются близко сцепленные, но противоположно импринтированные локусы: один из них активно экспрессируется на отцовской хромосоме, а другой – на материнской. Если эти гены работают – нет патологии. При их отсутствии или выключении развиваются синдром Прадера-Вилли или Энгельмана. Для синдрома Прадера-Вилли кандидатный ген экспрессируется на отцовской хромосоме, а для синдрома Энгельмана кандидатный ген экспрессируется на материнской хромосоме.
Синдром Прадера-Вилли.Развивается при:
- делеции участка 15 хромосомы отца (нет участка, который эксперессируется на отцовской хромосоме)
- однородительская дисомия 15 хромосомы материнского происхождения (в этом случае гены импринтированы – выключены или подавлены)
Проявления: умственная отсталость, мышечная гипотония, выраженное ожирение, гипогонадизм, низкий рост, маленькие дистальные отделы конечностей (акромикрия).
Источник
«Ãîëîâó êëàäÿ íà ïëàõó è âûïèâ ìèðíîå âèíî,
ß ïðàâäó ðàññêàæó ïðî Ñïàðòó è ïðî Àôèíû çàîäíî»
(Ë.Ôåéõòâàíãåð)
Íà îäíîì âïîëíå óâàæàåìîì è ïîñåùàåìîì ðåñóðñå âäðóã ïîÿâèëàñü ñòàòüÿ î òåëåãîíèè. ×òî ýòî ïîëíàÿ ÷åïóõà, ÿñíî óæå øêîëüíèêàì, ïî êðàéíåé ìåðå, íå ñëèøêîì çëîñòíî ïðîãóëèâàâøèì óðîêè áèîëîãèè. Ïîýòîìó ìåíÿ óäèâèëî îáñóæäåíèå òîãî îïóñà. Âðîäå áû âçðîñëûå, êàê áû îáðàçîâàííûå ëþäè ïóñòèëèñü â òàêèå ðàññóæäåíèÿ, ÷òî ÿ ñ÷åë ñâîèì äîëãîì âîçîïèòü, êàê òîò êñåíäç ó Èëüôà è Ïåòðîâà : «Äîêîíä ïàí èäçå?! Îïîìÿòàéñå, ïàí!».
Äèñêóññèÿ ïðèâåëà ê òîìó, ÷òî áåäíàÿ ìîÿ ãîëîâà ïîøëà êðóãîì, è ÿ ïîãðóçèëñÿ â èíòåðíåò â íàäåæäå âûóäèòü ïîíèìàíèå ñèòóàöèè íà «íàñòîÿùèé ìîìåíò».
Âñïëûëî íå÷òî òàêîå:
«Çàêîíû ÐÈÒÀ çàïðåùàþò ìåæðàñîâûå áðàêè ñëàâÿíñêèõ íàðîäîâ ñ íåãðîèäíûìè, ìîíãîëîèäíûìè, åâðååèäíûìè. Ñìåøåíèå Êðîâè âûøå ïåðå÷èñëåííûé íàðîäîâ ìåæäó ñîáîé ïðèâîäèò ê äåãðàäàöèè, çàáîëåâàíèþ êðîâè (ÑÏÈÄ), âûðîæäåíèþ âñåé âåòâè äàííîãî Ðîäà.
Çäîðîâàÿ íàñëåäñòâåííîñòü íàøèìè ïðåäêàìè ñîõðàíÿëàñü áëàãîäàðÿ äåâñòâåííîé ÷èñòîòå íåâåñòû, îò ãóëÿùåé äåâóøêè õîðîøåãî ïîòîìñòâà íå ïîëó÷èøü. Íðàâñòâåííî ïàäøóþ äåâóøêó ñ÷èòàëè èñïîð÷åííîé, íå äîñòîéíîé çàìóæåñòâà. Êîãäà þíîøà áðàë â æ¸íû «ïîð÷åíóþ» äåâóøêó, òàêîå âîññîåäèíåíèå íàçûâàëè «áðàêîì», à íå Ñåìåéíûì Ñîþçîì.
Ëþäè Ðîäîâ Ðàñû Âåëèêîé äîëæíû çíàòü, ÷òî ìóæ÷èíà, âî âðåìÿ ïîëîâîãî êîíòàêòà, îòäà¸ò æåíùèíå ýíåðãèþ îäíîãî ãîäà ñâîåé æèçíè: ýíåðãèÿ òð¸õ ìåñÿöåâ èä¸ò íà çàêðåïëåíèå Îáðàçà Äóõà è Êðîâè, à ýíåðãèÿ äåâÿòè ìåñÿöåâ íà âûíàøèâàíèå ïëîäà. È åñëè ìóæ÷èíà âåä¸ò áåñïîðÿäî÷íóþ ïîëîâóþ æèçíü, òî îí ðàñòðà÷èâàåò ïîíàïðàñíó ñâîþ Ýíåðãèþ Æèçíè, ÷òî ïðèâîäèò ê ïðåæäåâðåìåííîìó ñòàðåíèþ, îáëûñåíèþ. Àêàäåìèê Ïàâëîâ îòìå÷àë, ÷òî ñìåðòü ÷åëîâåêà äî 150 ëåò ñëåäóåò ñ÷èòàòü íàñèëüñòâåííîé. Íîðìà æèçíè íàøåãî áèîëîãè÷åñêîãî òåëà 300-400 ëåò.»
È òàêîãî áûëî òàê ìíîãî, ÷òî ïðèøëîñü îáúÿñíÿòü âðîäå áû âçðîñëûì è êàê áû îáðàçîâàííûì âåùè ñàìîî÷åâèäíûå. Êàê âûÿñíèëîñü, ñòàðàëñÿ íå çðÿ. Óçíàë î òåëåãîíèè è î ñâîåé ïåðñîíå ìíîãî íîâîãî è èíòåðåñíîãî.
Òåì áîëåå õî÷åòñÿ óâèäåòü ðåàêöèþ íà ìîé òðóä çäåøíåé àóäèòîðèè.
Èòàê, òåëåãîíèÿ.
Ñëîâîì «òåëåãîíèÿ» îáîçíà÷àþò ìèôè÷åñêèé áèîëîãè÷åñêèé çàêîí íàñëåäîâàíèÿ äåòüìè ñàìêè ïðèçíàêîâ å¸ ïåðâîãî ñàìöà. Èíà÷å ãîâîðÿ, íåçàâèñèìî îò òîãî, ñêîëüêî ñàìöîâ îïëîäîòâîðÿþò ñàìêó â òå÷åíèå å¸ æèçíè, ïîòîìñòâî áóäåò ïîõîæå íà ñàìîãî ïåðâîãî.
Íà÷àëî ýòîãî ñóåâåðèÿ ñâÿçûâàþò àæ ñ Àðèñòîòåëåì. Àâòîðèòåò åãî, äîñòàòî÷íî âûñîêèé â àíòè÷íîñòè, áûë âîçíåñåí äî íåáåñ ñðåäíåâåêîâûìè ñõîëàñòàìè. Ñîîòâåòñòâåííî âåðà âî âñå åãî îøèáêè áûëà áåçîãîâîðî÷íîé. Ïîòîì ýòî êàê-òî ïðèòèõëî.
Íà ðóáåæå Õ1Õ — ÕÕ âåêîâ î òåëåãîíèè çàãîâîðèëè ñíîâà.
Ñàìîå çàáàâíîå, ÷òî âîçðîæäåíèå èíòåðåñà ê òåëåãîíèè ñâÿçàíî ñ èìåíåì âåëè÷àéøåãî áèîëîãà ×àðëüçà Äàðâèíà. Äàðâèí â îäíîì èç ñâîèõ òðóäîâ ïðèâåë îïèñàíèå ñëó÷àÿ ñ êîáûëîé ëîðäà Ìîðòîíà.
=======
Îíà èìåëà 7/8 àðàáñêîé è 1/8 àíãëèéñêîé êðîâè è áûëà ïîêðûòà (â 1815 ãîäó) êâàããîé(âûìåðøàÿ íûíå ðîäñòâåííèöà çåáðû), áåç ðîæäåíèÿ ïîòîìñòâà.  1817, 1818 è 1823 ãîäàõ ýòà êîáûëà áûëà ïîêðûòà æåðåáöîì å¸ ïîðîäû. Ðîæä¸ííûå ïîñëå ýòîãî æåðåáÿòà áûëè ïîõîæè (ïî æåñòêîñòè ø¸ðñòíîãî ïîêðîâà, ãíåäîé ìàñòè, ïî íàëè÷èþ ò¸ìíûõ ïÿòåí è ïîëîñ âäîëü õðåáòà, ïî ïëå÷àì è çàäíèì ó÷àñòêàì íîã) íà êâàããó â òàêîé ñòåïåíè, êàê åñëè áû îíè èìåëè 1/16 êðîâè êâàããè.
=======
Ñàì ×àðëüç Äàðâèí îáúÿñíÿë ýòîò ñëó÷àé èçâåñòíûìè ÿâëåíèåì àòàâèçìà ïðîÿâëåíèåì â ïîòîìñòâå ïðèçíàêîâ îòäàëåííûõ ïðåäêîâ. Íî ê øèðîêîé ïóáëèêå ýòà âïîëíå áàíàëüíàÿ èñòîðèÿ ïîïàëà â ïåðåñêàçå èçâåñòíîãî ôðàíöóçñêîãî àòåèñòà è ñëàáîãî áèîëîãà Ëå Äàíòåêà. Ñåé ó÷åíûé ìóæ ïèñàë: «Íåëüçÿ äîïóñòèòü, ÷òîáû ïîáî÷íûå äåòè íå èìåëè íèêàêèõ ïðèçíàêîâ ìóæà èõ ìàòåðè, åñëè ýòà ïîñëåäíÿÿ õîòÿ áû ðàç íå áûëà îïëîäîòâîðåíà èì È ðåá¸íîê, ðîäèâøèéñÿ îò æåíùèíû, ó êîòîðîé ðàíåå áûëî ìíîãî äåòåé îò ðàçíûõ ïàðòí¸ðîâ, ìîæåò èìåòü ïðèçíàêè îòî âñåõ ýòèõ ïðåäûäóùèõ (ïàðòí¸ðîâ) îòöîâ.» È ïîíåñëîñü…
Ýêñïåðèìåíòàëüíîé ïðîâåðêå òåëåãîíèÿ ïîäâåðãàëàñü ìíîæåñòâî ðàç, â òîì ÷èñëå è â Ðîññèè, â çàïîâåäíèêå «Àñêàíèÿ- Íîâà», ãäå ñêðåùèâàëè ëîøàäåé è çåáð. Áûëè îïûòû ñ ñîáàêàìè è ãîëóáÿìè â ðàçíûõ ñòðàíàõ. Íè ðàçó â ñòðîãèõ ýêñïåðèìåíòàõ òåëåãîíèÿ íå íàáëþäàëàñü.
Òåì íå ìåíåå, «èäåÿ ïîøëà â íàðîä». ßâëåíèÿ, íàïîìèíàþùèå òåëåãîíèþ, âðåìÿ îò âðåìåíè ñëó÷àëèñü , ÷òî ìîìåíòàëüíî ïîäõâàòûâàëîñü è ïðèìåíÿëîñü äëÿ ïîâûøåíèÿ áëàãîñîñòîÿíèÿ êîíå-, ãîëóáå- , ñîáàêî- è ïðî÷èõ çàâîä÷èêîâ. À òàêî æå äëÿ ïðîïàãàíäû öåëîìóäðèÿ è ïðî÷èõ âå÷íî þíûõ öåííîñòåé.
Ïî áîëüøîìó ñ÷åòó, áóäü ýòà ñàìàÿ òåëåãîíèÿ ðåàëüíîñòüþ, íà íå¸ ìîëèòüñÿ íàäî áûëî áû! Çàâåç â ñòðàíó îäíîãî ïëåìåííîãî áûêà èç Àðãåíòèíû, ñêàæåì. Îí ïåðåèìåë âñåõ ò¸ëîê â ïðåäåëàõ äîñÿãàåìîñòè è ãîòîâî! Êîðîâû âñþ æèçíü äî ìÿñîêîìáèíàòà ðîæàþò ýëèòíîå ïîòîìñòâî, êàêîé áû áëåäíîé íåìî÷üþ èõ ïîòîì íå ïîêðûâàëè.
Òàê íåò æå, îòêàçûâàëèñü ñêîòîâîäû îò òàêèõ îãðîìàäíûõ ñâåðõïðèáûëåé. Ñîâåñòü ó íèõ ãèïåðòðîôèðîâàíà, íå èíà÷å. Èëè îíè ïðîñòî áûëè íå äóðàêè, â îòëè÷èå îò òåõ, êîìó âïàðèâàëè ñêàçêè ïðî òåëåãîíèþ?
 ãîäû òàê ýòî 1912 15 òåëåãîíè÷åñêàÿ àõèíåÿ ðåçêî ñîøëà íà íåò. Ïî÷åìó? Íàðîä òîãäà çäîðîâî èíòåðåñîâàëñÿ óñïåõàìè åñòåñòâåííûõ íàóê, à íàóêà ïðèøëà ê ïåðåîòêðûòèþ çàêîíîâ çàáûòîãî Ãðåãîðà Ìåíäåëÿ è ðîäèëà ãåíåòèêó.
Íå îñèëèâøèõ â ñðåäíåé øêîëå îñíîâû ýòîé çàìå÷àòåëüíîé íàóêè, ïðèçûâàþ ïîâåñèòü ñâîè óøè íà ãâîçäü âíèìàíèÿ, à ìîçãè âîäðóçèòü íà ñòîë ïîíèìàíèÿ.
================
Íàñëåäñòâåííàÿ èíôîðìàöèÿ äèñêðåòíà, è îò ðîäèòåëåé ê äåòÿì ïåðåäàåòñÿ ìàòåðèàëüíûìè íîñèòåëÿìè, èìåíóåìûìè ãåíàìè. Ãåí ýòî êàê áû àòîì èëè, òî÷íåå, êâàíò íàñëåäñòâåííîé èíôîðìàöèè. Ðàñïîëîæåíû ãåíû â îñîáûõ âíóòðèêëåòî÷íûõ îáðàçîâàíèÿõ, èìåíóåìûõ õðîìîñîìàìè. Ó ðàçíûõ âèäîâ æèâûõ îðãàíèçìîâ ñâî¸ ÷èñëî õðîìîñîì: îò 2 äî 1400. Ó ÷åëîâåêà 46. Âåðíåå, 23 ïàðû. Âî âñåõ êëåòêàõ äàííîãî îðãàíèçìà õðîìîñîìû áûâàþò òîëüêî ïàðàìè. Ãåí ýòà òà ìèíèìàëüíàÿ åäèíèöà íàñëåäñòâåííîé èíôîðìàöèè, êîòîðàÿ îïðåäåëÿåò îäèí ïðèçíàê (ñâîéñòâî îðãàíèçìà). Îäèí ãåí îäèí ïðèçíàê. (ß ïðåäåëüíî óïðîùàþ ìàòåðèàë.) Ñîâîêóïíîñòü ãåíîâ äàííîãî îðãàíèçìà íàçûâàåòñÿ ãåíîòèïîì. Ñîâîêóïíîñòü ïðèçíàêîâ — ôåíîòèïîì.
Ãåíû ñóùåñòâóþò â äâóõ âàðèàíòàõ àëëåëÿõ. Áûâàþò àëëåëè äîìèíàíòíûå, ñèëüíûå. Ïðè èõ íàëè÷èè ïðèçíàê ïðîÿâëÿåòñÿ â ôåíîòèïå â òîì âèäå, ÷òî çàäàåòñÿ äàííûì àëëåëåì. Âòîðîé âàðèàíò ðåöåññèâíûé àëëåëü, ñëàáûé.  ïðèñóòñòóâèè äîìèíàíòíîãî îí íå ïðîÿâèò ñåáÿ íèêàê. Íî, åñëè â ïàðå õðîìîñîì âñòðåòÿòñÿ äâà ðåöåññèâíûõ àëëåëÿ, òî èõ äåéñòâèå ïðîÿâèòñÿ â ôåíîòèïå.
Âñ¸ âûãëÿäèò ïðîñòî. Íî íà ñàìîì äåëå ãåíû íå òîëüêî íåïîñðåäñòâåííî îïðåäåëÿþò ïðèçíàêè. Îíè åùå âçàèìîäåéñòâóþò ìåæäó ñîáîé: âçàèìíî óñèëèâàþò è îñëàáëÿþò äåéñòâèå, âêëþ÷àþò è âûêëþ÷àþò, äóáëèðóþò è áëîêèðóþò… À îðãàíèçì, êàê òàêîâîé, åãî ôåíîòèï ôîðìèðóåòñÿ åùå è ïîä âëèÿíèåì ôàêòîðîâ âíåøíåé ñðåäû.
Âûøå áûëî ñêàçàíî, ÷òî âñå êëåòêè îðãàíèçìà èìåþò äâîéíîé — äèïëîèäíûé íàáîð õðîìîñîì. Âñå. Êðîìå ïîëîâûõ. Â ãåíåòèêå îíè èìåíóþòñÿ ãàìåòàìè. Ãàìåòû èìåþò ïîëîâèííûé, ãàïëîèäíûé íàáîð. Ñëåäóåò îòìåòèò, ÷òî êàê íîñèòåëè íàñëåäñòâåííîé èíôîðìàöèè ãàìåòû — ÿéöåêëåòêè è ñïåðìàòîçîèäû àáñîëþòíî ðàâíîïðàâíû.
Ïðè îïëîäîòâîðåíèè ÿäðà ãàìåò ñëèâàþòñÿ è îáðàçóåòñÿ çèãîòà ïåðâàÿ êëåòêà áóäóùåãî îðãàíèçìà, íåñóùàÿ ïîëíûé äèïëîèäíûé íàáîð õðîìîñîì. Èç íå¸ ïîòîì ôîðìèðóåòñÿ íîâûé îðãàíèçì. Ãåíîòèï è ôåíîòèï íîâîãî îðãàíèçìà îïðåäåëÿþòñÿ — â ïåðâóþ î÷åðåäü êîìáèíàöèåé äîìèíàíòíûõ è ðåöåññèâíûõ àëëåëåé â ÿäðàõ êëåòîê è ñëîæíîé èãðîé âíóòðåííèõ è âíåøíèõ ôàêòîðîâ.
Ãëàâíîå: ñâîéñòâà îðãàíèçìà çàäàþòñÿ â ìîìåíò îïëîäîòâîðåíèÿ ñî÷åòàíèåì ìàòåðèíñêèõ è îòöîâñêèõ ãåíîâ èç äàííûõ ãàìåò, îáðàçîâàâøèõ äàííóþ çèãîòó.
Íè÷åãî ñâåðõ ýòîãî â çà÷àòèè íå ó÷àñòâóåò. Ñëåäóþùåå çà÷àòèå áóäåò ðåçóëüòàòîì äðóãèõ, íà òîò ìîìåíò äàííûõ, ãàìåò. È íè÷åãî áîëåå.
=========
Ñïåðìàòîçîèä ìóæñêàÿ ãàìåòà ýòî î÷åíü «ñëàáàÿ» êëåòêà. Ëèøåííûé ñïîñîáíîñòè ïîëó÷àòü ýíåðãèþ èçâíå, èìåþùèé ìíèíèìàëüíûé çàïàñ âíóòðåííèõ ðåñóðñîâ, ñïåðìàòîçîèä îñòàåòñÿ æèâûì íåñêîëüêî ÷àñîâ âî âëàãàëèùå æåíùèíû è äî òðåõ ñóòîê â ìàòêå è ôàëëîïèåâûõ òðóáàõ.
Íèêàêèõ äðóãèõ ïåðåíîñ÷èêîâ ãåíîâ, êðîìå õðîìîñîì â ãàïëîèäíûõ ÿäðàõ ãàìåò, â ïðèðîäå íå ñóùåñòâóåò
Òàêèì îáðàçîì, òðîå ñóòîê ìàêñèìàëüíûé âîçìîæíûé ñðîê ïðèñóòñòâèÿ ìóæñêîé íàñëåäñòâåííîé èíôîðìàöèè â æåíñêîì òåëå.
×òî ìû èìååì , óñâîèâ âûøåèçëîæåííîå?
×òî òåëåãîíèÿ äàæå â ïðèíöèïå íåâîçìîæíà!
Íè «î÷åíü ðåäêî», íè ÷àñòî íèêîãäà è íè ïðè êàêèõ îáñòîÿòåëüñòâàõ.
Ó ïðèðîäû ïðîñòî íåò ìåõàíèçìà äëÿ ýòîãî ÿâëåíèÿ. Îíà íåâîçìîæíà, êàê õîä èãðóøå÷íûõ ÷àñîâ ñ íàðèñîâàííûìè ñòðåëêàìè. Êîãäà ýòî âûÿñíèëîñü, òåëåãîíèÿ âðîäå áû åùå ðàç è îêîí÷àòåëüíî óìåðëà. Òóäà åé è äîðîãà.
Íî â ïîñëåäíèå ãîäû ýòî ñóåâåðèå ñíîâà ïîäíÿëî ãîëîâó. Ïèòàòåëüíîé ïî÷âîé äëÿ ýòîé «ðåàíèìàöèè» ñòàëî íîâàÿ íàó÷íàÿ áåçãðàìîòíîñòü. Óäèâèòåëüíàÿ â íàøå âðåìÿ àíòèíàó÷íàÿ èñòåðèÿ. Ñòðåìèòåëüíûé ïîäúåì ðåëèãèè è ñóåâåðèé.
À «ðåàíèìàòîðàìè» — íåîíàöèñòû, íàöèîíàëèñòû è ïðî÷èå áîðöû çà «÷èñòîòó êðîâè».
Íî ýòî îòäåëüíàÿ áîëüøàÿ, ñëîæíàÿ è êðàéíå íåïðèÿòíàÿ òåìà.
Источник
В
настоящее время описано достаточно
много заболеваний, которые в современной
классификации наследственной патологии
человека объединяют в отдельную группу:
болезни с нетрадиционным типом
наследования. Среди них различают:
болезни импринтинга, митохондриальные
болезни, болезни экспансии тринуклеотидных
повторов с явлением антиципации и др.
Болезни
импринтинга.
Особенности наследования и фенотипического
проявления при болезнях импринтинга
обусловлены явлением геномного
импринтинга (ГИ) (импринтинг от англ.
imprinting — запечатление).
Явление
геномного импринтинга связывают со
специфическими изменениями хромосом
или их участков во время образования
мужских и женских гамет. Этим объясняется
дифференциальная маркировка отцовских
и материнских хромосом у потомков.
Точные
механизмы дифференциальной маркировки
хромосом или их участков в сперматогенезе
или овогенезе пока окончательно не
выяснены. Однако, немаловажная роль,
вероятно, принадлежит процессам
специфического метилирования цитозиновых
оснований ДНК, выключающим транскрипцию
гена.
Импринтированные
участки в хромосомах определенного
родительского происхождения (отцовских
иди материнских) избирательно
репрессируются у потомка. В связи с этим
фенотипически проявляется только
информация, полученная от другого
родителя, т.е. имеет место моноаллельная
экспрессия. Следовательно, фенотипическое
проявление мутантного аллеля зависит
от того с какой половой клеткой
(яйцеклеткой или сперматозоидом) он был
передан потомку.
Явлением
ГИ объясняется, например, избирательная
инактивация у млекопитающих отцовской
Х-хромосомы в клетках провизорных
органов. В клетках самого зародыша имеет
место равновероятная инактивация
отцовской и материнской Х-хромосом.
Таким
образом, следствием ГИ (дифференциальной
маркировки в гаметогенезе родителей и
последующей избирательной инактивации
у потомков участков хромосом) является
функциональная неравноценность в
генотипе потомка аллелей разного
родительского происхождения.
Митохондриальные
болезни —
связь некоторых видов наследственной
патологии у человека с мутациями
митохондриальной ДНК.
болезни,
вызванные точковыми мутациями,
приводящими к замене консервативных
аминокислот в собственных белках
митохондрий (пигментный ретинит и
нейроофтальмопатия Лебера, при которой
наступает двусторонняя потеря зрения);болезни,
вызванные мутациями в генах т-РНК,
приводящими к многочисленным
дегенеративным заболеваниям с различной
степенью тяжести клинических проявлений,
коррелирующей с количеством мутантной
мтДНК;болезни,
вызванные делениями и дупликациями
участков митохондриалъных генов
(отсроченная кардиопатия, при которой
обнаружены делеции мтДНК кардиоцитов,
заболевание носит семейный характер);болезни,
вызванные снижением числа копий мтДНК,
что является следствием определенных
мутаций (летальная инфантильная
дыхательная недостаточность и синдром
молочнокислого ацидоза).
Изменения
в ДНК митохондрий сопровождаются
нарушением их функций, связанных с
клеточным дыханием. Это определяет
характер и степень тяжести клинических
проявлений митохондриалъных болезней.
Болезни
экспансии тринуклеотидных повторов.
Данная патология зависит от количества
тринуклеотидных повторов в мутантном
аллеле. Чем их больше, тем тяжелее
протекает болезнь. Поскольку количество
повторов формируется в мейозе у одного
из родителей, может быть более тяжёлое
течение в последующих поколениях, что
связано с их увеличением. Клиническая
картина зависит от дозы генов. Примером
является синдром Мартина-Белла (умственной
отсталости с ломкой Х-хромосомой).
Фенотип: удлинённое лицо, выступающий
лоб, большие оттопыренные уши, большие
кисти и стопы, умственная отсталость.
Цитогенетика: отличается ломкостью в
дистальной части длинного плеча
Х-хромосомы (Хq), что напоминает «спутник».
Общие
подходы к лечению наследственных
болезней сходны с подходами к лечению
болезней любой другой этиологии. При
наследственных болезнях полностью
сохраняется принцип индивидуализированного
лечения, ведь врач и при наследственной
патологии лечит не просто болезнь, а
болезнь конкретного человека. Возможно,
что при наследственной патологии принцип
индивидуализированного лечения должен
соблюдаться еще строже, потому что
гетерогенность наследственных болезней
далеко не расшифрована, а, следовательно,
одну и ту же клиническую картину могут
вызвать разные наследственные болезни
с различным патогенезом. В зависимости
от условий пре- и постнатального
онтогенеза, а также от всего генотипа
человека фенотипические проявления
мутаций у конкретного человека могут
модифицироваться в ту или другую сторону.
Следовательно, необходима разная
коррекция наследственной болезни у
разных пациентов.
Соседние файлы в предмете Биология
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
В последние годы стало очевидным, что далеко не все случаи наследственной патологии у человека можно рассматривать как результат менделирующих генных мутаций, хромосомных аномалий или как мультифакториальные заболевания (МФЗ).
В настоящее время описано достаточно много заболеваний, которые в современной классификации наследственной патологии человека объединяют в отдельную группу: болезни с нетрадиционным типом наследования. Среди них различают: болезни импринтинга, митохондриальные болезни, болезни экспансии тринуклеотидных повторов с явлением антиципации и др.
Особенности наследования и фенотипического проявления при болезнях импринтинга обусловлены явлением геномного импринтинга (ГИ) (импринтинг — от англ, imprinting — запечатление).
Явление геномного импринтинга связывают со специфическими изменениями хромосом или их участков во время образования мужских и женских гамет. Этим объясняется дифференциальная маркировка отцовских и материнских хромосом у потомков.
Точные механизмы дифференциальной маркировки хромосом или их участков в сперматогенезе или овогенезе пока окончательно не выяснены. Однако немаловажная роль, вероятно, принадлежит процессам специфического метилирования цитозиновых оснований ДНК, выключающим транскрипцию гена.
Импринтированные участки в хромосомах определенного родительского происхождения (отцовских или материнских) избирательно репрессируются у потомка. В связи с этим фенотипически проявляется только информация, полученная от другого родителя, т.е. имеет место моноаллельная экспрессия. Следовательно, фенотипическое проявление мутантного аллеля зависит от того, с какой половой клеткой (яйцеклеткой или сперматозоидом) он был передан потомку.
Явлением ГИ объясняется, например, избирательная инактивация у млекопитающих отцовской Х-хромосомы в клетках провизорных органов (см. разд. 6.5.4.). В клетках самого зародыша имеет место равновероятная инактивация отцовской и материнской Х-хромосом (см. рис. 3.78).
Таким образом, следствием ГИ (дифференциальной маркировки в гаметогенезе родителей и последующей избирательной инактивации у потомков участков хромосом) является функциональная неравноценность в генотипе потомка аллелей разного родительского происхождения.
Связь этиологии ряда наследственных заболеваний с феноменом ГИ может быть прослежена на разных уровнях организации генетического материала.
На геномном уровне организации наследственного материала доказательством роли ГИ в патологии служит различное фенотипическое проявление тригогоидных состояний при разном соотношении гаплоидных наборов отцовского и материнского происхождения.
У диандрических триплоидов (соотношение числа гаплоидных наборов отца и матери 2 : 1) и у дигенических триплоидов (соотношение 1 : 2) патологические отклонения в развитии плаценты и собственно зародышевых тканей проявляются по-разному. Это свидетельствует о неравноценности функционирования гаплоидных наборов отца и матери в тканях зародыша и плаценты (см. разд. 6.5.4 и 6.6.1).
Связь феномена ГИ с патологией на уровне отдельных хромосом можно проследить в случае однородительской дисомии (ОРД), при которой происходит удвоение хромосомы одного из родителей при утрате гомологичной хромосомы другого родителя.
В основе возникновения ОРД лежит нарушение процессов гамето- генеза. При нерасхождении сестринских хроматид в анафазе II мей- оза появляются гаметы, в галлоидном наборе которых присутствуют две генетически идентичные хромосомы (изодисомия).
В случае нерасхождения гомологичных хромосом в анафазе I мей- оза образуются гаметы, в гаплоидном наборе которых имеется пара гомологичных, генетически неидентичных хромосом (гетеродисо- мия). В обоих случаях гаметы данного индивида дисомны по одной из хромосом.
При оплодотворении дисомных гамет нулисомными по той же хромосоме половыми клетками происходит комплементация гамет, приводящая к возникновению нормального диплоидного кариотипа зиготы. Однако в генотипе такой зиготы присутствует двойной набор генов данной хромосомы, происходящих от одного, а не от обоих родителей.
Иногда оплодотворение дисомных гамет нормальными половыми клетками сопровождается «коррекцией трисомии» в результате потери сверхчисленной хромосомы. Если при этом сохраняются две хромосомы, пришедшие от одного родителя, то наблюдается явление ОРД.
Наконец, состояние ОРД по отдельным локусам хромосом может возникать в результате соматической рекомбинации — кроссинго- вера между хроматидами гомологичных хромосом, происходящего в соматических клетках (см. рис. 3.73).
Когда хромосома не содержит импринтированных участков, при ОРД по данной хромосоме может не наблюдаться аномалий фенотипа. Исключением может быть проявление аутосомно-рецессив- ного заболевания как результат гомозиготизации по рецессивному аллелю при изодисомии.
Если хромосома содержит импринтированные участки, то при возникновении однородительской дисомии локализованные в них аллели могут быть либо экспрессированы, либо инактивированы в зависимости от родительского происхождения ОРД. Это может стать причиной возникновения патологических отклонений в развитии организма. Фенотипическое проявление при ОРДмат и ОРДотц может быть сходным или прямо противоположным. Возможен летальный эффект уже на ранних сроках развития.
В настоящее время эффект импринтинга установлен достаточно определенно для четырех хромосом человека: 15, 11, 7, 14-й. Так в проксимальном отделе длинного плеча 15-й хромосомы имеется район, подверженный импринтингу. Мутации, связанные с микроделециями в этом районе, приводят к развитию у человека синдрома Прадера — Вилли, при котором у пациентов наблюдается умственная отсталость, мышечная гипотония, сильное ожирение, гипогонадизм, низкий рост, акромикрия (непропорционально малые размеры дистальных отделов конечностей). В настоящее время описано более 30 случаев синдрома Прадера — Вилли, когда у пациентов определяется ОРДмат 15. Считается, что ОРДмат 15 является причиной 20—25% всех случаев этого синдрома. Большая же часть остальных случаев заболевания связана с делецией сегмента 15qll — ql3 отцовской хромосомы. Указанный пример свидетельствует об активной экспрессии соответствующего участка 15-й хромосомы исключительно отцовского происхождения. В материнской же хромосоме он метилирован и репрессирован.
Делеция другого участка, также расположенного в сегменте 15qll — ql3, но в 15-й хромосоме материнского происхождения, в 70% случаев приводит к развитию синдрома Энгельмана (синдрома «счастливой куклы»), характеризующегося глубокой умственной отсталостью с резкими судорожными движениями и неадекватной счастливой улыбкой. В 2% случаев этот синдром обусловлен ОРДотц15.
Из сказанного выше следует, что в проксимальном районе длинного плеча 15-й хромосомы имеются близкорасположенные и противоположно импринтированные локусы, отвечающие за возникновение фенотипически различных синдромов Прадера — Вилли и Энгельмана.
Таким образом импринтироваться могут участки хромосом разного родительского происхождения, что и определяет нетрадиционное наследование многих патологических состояний, обусловленных мутациями локусов, подверженных импринтингу.
Начиная с конца 80-х гг. XX в. получены убедительные доказательства связи некоторых видов наследственной патологии у человека с мутациями митохондриальной ДНК (см. гл. 4.1). В зависимости от типа мутаций митохондриальные болезни разделяют на 4 группы:
- а) болезни, вызванные точковыми мутациями, приводящими к замене консервативных аминокислот в собственных белках митохондрий. К ним относятся пигментный ретинит и нейроофтальмо- патия Лебера, при которой наступает двусторонняя потеря зрения. Выраженность клинических признаков у больных этими заболеваниями коррелирует с количеством мутантной мтДНК, которое у разных больных может варьироваться от 5 до 100% всей мтДНК;
- б) болезни, вызванные мутациями в генах тРНК, приводящими к многочисленным дегенеративным заболеваниям с различной степенью тяжести клинических проявлений, коррелирующей с количеством мутантной мтДНК;
- в) болезни, вызванные делециями и дупликациями участков митохондриальных генов. У человека описано тяжелое заболевание молодого и среднего возраста — отсроченная кардиопатия, при которой обнаружены делеции мтДНК кардиоцитов. Заболевание носит семейный характер. В ряде случаев предполагается Х-сцепленное наследование, что позволяет думать о существовании ядерного гена, мутация которого вызывает делецию до 50% мтДНК кардиоцитов;
- г) болезни, вызванные снижением числа копий мтДНК, что является следствием определенных мутаций. К данной группе относятся летальная инфантильная дыхательная недостаточность и синдром молочнокислого ацидоза, при которых число копий мтДНК снижается до 1—2% от нормы. Снижение содержания мтДНК в клетках различных органов приводит к развитию миопатий, нефропатий, печеночной недостаточности и т.д. вследствие ослабления синтеза белков, кодируемых мтДНК.
Изменения в ДНК митохондрий сопровождаются нарушением их функций, связанных с клеточным дыханием. Это определяет характер и степень тяжести клинических проявлений митохондриальных болезней.
Выдвинута также гипотеза о том, что накопление спонтанно возникающих мутаций мтДНК является звеном механизмов старения и развития дегенеративных процессов у человека.
Болезни экспансии тринуклеотидных повторов с явлением антиципации. Под генетической антиципацией (или упреждением) понимается более раннее проявление и возрастание тяжести симптомов наследственного заболевания в последующих поколениях родословной. Антиципация реально проявляется при определенных видах моногенной неврологической патологии, а также при некоторых мультифакториальных заболеваниях.
В начале 90-х гг. XX в. при исследовании ряда тяжелых неврологических заболеваний были обнаружены «динамические» мутации с экспансией (резким увеличением числа копий) тринуклеотид- ных повторов у индивидов в последующих поколениях родословной. Развивающиеся в результате таких мутаций наследственные заболевания характеризуются четко выраженным проявлением антиципации.
Феномен экспансии числа тринуклеотидных повторов был впервые обнаружен при исследовании синдрома Мартина — Белла или синдрома фрагильной (ломкой) Х-хромосомы, основным фенотипическим проявлением которого является умственная отсталость. Синдром ломкой Х-хромосомы характеризуется довольно широкой распространенностью в популяции (1 : 1000) и необычным характером наследования. Лишь у 80% мужчин — носителей мутантного локуса имеются клинические и цитогенетические признаки заболевания. 20% носителей как клинически, так и цитогенетически нормальны, но после передачи мутации всем своим дочерям они могут иметь пораженных внуков. Неэкспрессируемый мутантный ген в таком случае становится экспрессируемым в последующих поколениях.
Таким образом, мутантный ген при синдроме ломкой Х-хромо- сомы может существовать в двух формах, отличающихся по своей пенетрантности. Одна — фенотипически не проявляющаяся — премутация, которая при прохождении через женский мейоз превращается в другую форму — полную мутацию. При таком необычном способе наследования и фенотипического проявления мутантного гена, отличном от классического Х-сцепленного наследования, обнаруживается феномен антиципации — более тяжелое проявление заболевания в последующих поколениях.
В основе клинических проявлений и цитологической нестабильности в локусе, ответственном за синдром ломкой Х-хромосомы, лежит многократное увеличение повторов тринуклеотида ЦГГ.
В норме число повторов колеблется от 5 до 50. Премутация — неэк- спрессируемая форма — характеризуется увеличением числа повторов до 50—200. Возрастание числа повторов тринуклеотида ЦГГ свыше 200 приводит к клинической манифестации заболевания и цитогенетическому проявлению ломкой Х-хромосомы. Как правило, у пораженных лиц наблюдается также аномальное метилирование ДНК, приводящее к репрессированию гена.
Интересно, что переход от состояния премутации к полной мутации возникает при передаче от матери, причем экспансия ЦГГ-повторов значительно выше при передаче от матери к сыну, чем от матери к дочери.
Антиципация, характерная для синдрома ломкой Х-хромосомы, объясняется четкой связью между числом тринуклеотидных повторов и тяжестью клинических проявлений заболевания с цитологической экспрессией ломкости Х-хромосомы.
Таблица 7.3. Некоторые заболевания человека, связанные с экспансией
тринуклеотидных повторов
Вид патологии | Локализация гена | Тринуклеотидный повтор | Число тринуклеотидных повторов | |
норма | патология | |||
Синдром ЛОМКОЙ Х-хромосомы (FRAXA) | Xq 27,3 | цгг | 5—50 | >200 |
Спино-бульбарная мышечная атрофия | Xq 11-12 | ЦАГ | 17—26 | 40—52 |
Миотоническая дистрофия | 19q 13,3 | цтг | 5—27 | 50—1600 |
Хорея Гентингтона | 4р 16,3 | ЦАГ | 11—34 | >42 |
Увеличение числа тринуклеотидных повторов и связанное с этим явление антиципации обнаружены при целом ряде заболеваний (табл. 7.3). Например, при аутосомно-доминантном заболевании — хорее Гетингтона — выявляется четкая корреляция между числом ЦАГ-повторов и возрастом дебюта заболевания. У потомков пораженных отцов обнаруживается более тяжелое клиническое течение заболевания. Экспансия числа тринуклеотидных повторов происходит в мужском гаметогенезе.
Таким образом, в настоящее время описан новый класс наследственных болезней (около 10 заболеваний), при которых проявляется феномен антиципации, материнский или отцовский эффект, варьирующаяся пенетрантность. Установлена связь указанных особенностей наследования и фенотипического проявления этих заболеваний с возникновением динамических мутаций, приводящих к экспансии тринуклеотидных повторов.
Болезни, связанные с мутациями соматических клеток, описаны в разд. 4.2.1.
Источник
