Современные подходы к лечению болезни паркинсона статьи в рмж
Второй центральный военный клинический госпиталь им. П.В. Мандрыка, Москва
Болезнь Паркинсона (БП) – хроническое заболевание нервной системы, характеризующееся расстройствами преимущественно двигательных функций в виде гипокинезии, тремора и изменений мышечного тонуса. Наиболее яркие клинические проявления дрожательного паралича описаны Джеймсом Паркинсоном в 1817 г. Основные симптомы БП – брадикинезия и дискинезия, мышечная ригидность, тремор и постуральная неустойчивость – определяют течение заболевания и составляют его клиническую картину. Кроме БП, которую связывают преимущественно с нейродегенеративным процессом, выделяют синдром паркинсонизма, который может проявляться характерными акинетико-ригидными расстройствами при различных повреждениях мозга: сосудистый, токсический, лекарственный, посттравматический, постэнцефалитический паркинсонизм [11, 14]. Мышечная гипертония — гипокинезия лишает больного возможности содружествнных координированных движений, а дрожание создает серьезные препятствия для самообслуживания и профессиональной деятельности [2]. Симптоматика БП не ограничивается только двигательными расстройствами. Вегетативные дисфункции можно отметить у больных с паркинсонизмом достаточно часто [2, 10]. В связи с особенностями патобиохимии мозга при этом заболевании динамический баланс смещается в сторону преобладания парасимпатического тонуса вегетативной нервной системы. Артериальная гипотония и запоры, как проявления вегетативной дисфункции считаются характерными признаками паркинсонизма. Повышенная сальность кожи (“масляное лицо”), гиперсаливация, артрозы мелких суставов, ломкость ногтей, остеопороз, снижение массы тела обычно сопутствуют нарушениям движений. Вегетативные расстройства могут носить и пароксизмальный характер, преимущественно в виде ваго-инсулярных кризов, но нередко можно отметить пароксизмы головокружений, диффузной потливости, кардиалгии, учащенное мочеиспускание. Нарушения психики отмечаются примерно у 85% больных. Для паркинсонизма более характерны проявления депрессии [12, 21]. Нередко двигательные симптомы зависят от психоэмоционального состояния больного: тремор усиливается при эмоциональном напряжении и уменьшается в покое. Замедленное мышление (брадифрения) в сочетании с депрессией приводят к тяжелым расстройствам когнитивных функций вплоть до деменции [2, 13].
Паркинсонизм относится к весьма распространенным заболеваниям и с его клиническими проявлениями сталкиваются врачи разных специальностей. БП чаще диагностируется в возрасте 70–79 лет (до 300 на 100000 населения), однако регистрируются отдельные случаи заболевания у лиц до 40 лет.
Паркинсонизм одно из немногих заболеваний нервной системы при котором достаточно хорошо известны биохимические механизмы патологического процесса. Многочисленными исследованиями показано, что биохимическим субстратом БП является нарушение нейротрансмиттерного баланса в базальных узлах головного мозга [1, 4, 13, 15]. В связи с дегенерацией дофаминергических нигростриарных нейронов в полосатом теле возникает дефицит дофамина – важнейшего нейромедиатора, посредством которого осуществляются основные моторные функции [5]. При нарушении нейромедиаторного обмена затрудняется реализация двигательных стимулов, возникает преобладание холинергической активности с соответствующими проявлениями нейровегетативной дисфункции. В последние годы появились сообщения о значении в патогенезе заболевания не только недостаточности выработки дофамина, но и о нарушении чувстительности специфических рецепторов к действию дофамина [3, 6]. Среди компетентных рецепторных групп выделяют подсемейство рецепторов D2, имеющих особое значение в формированиии двигательных реакций [7, 22].
Установленные патобиохимические механизмы определяют основные группы лекарственных средств, применяемых при БП. Это препараты заместительной терапии леводопасодержащие лекарственные средства (леводопа биохимический предшественник дофамина). Из них широкое распространение получили такие препараты как наком и мадопар. Некоторые лекарственные средства способствуют увеличению синтеза дофамина (амантадин). Холинолитики используются для восстановления равновесия в системе нейромедиаторов, в комплексной терапии паркинсонизма они устраняют симптомы вегетативной дисфункции. В последние годы активно разрабатывается новое направление в терапии БП, основанное на примении средств, увеличивающих чувствительность нейрорецепторного аппарата к дофамину – агонисты дофаминовых рецепторов (АДР). Полагают, что именно стимуляция этих рецепторов обеспечивает основной антипаркинсонический эффект [8, 16]. Наиболее известным представителем этой группы препаратов является бромокриптин.
Парадокс заключается в том, что знание основных механизмов развития патологического процесса при БП и наличие нескольких групп лекарственных средств патогенетического действия не привело к решению проблемы паркинсонизма. Применение леводопасодержащих препаратов часто дает весьма заметный клинический эффект, но с течением требуется повышение дозы, формируется четкая зависимость двигательных функций от приема препаратов (синдром “включения-выключения”). При повышении дозы присоединяются побочные эффекты в виде гиперкинезов или нарушений психики. Согласно некоторым экспериментальным данным леводопа оказывает токсическое действие на дофаминовые нейроны [8, 23]. Назначение холинолитиков является скорее симптоматическим и редко оказывается достаточно эффективным. Препараты, способствующие выработке дофамина при наличии выраженных нейродегенеративных изменений тканей мозга не приносят устойчивого улучшения. АДР, полученные из спорыньи (производные эрготамина) имеют многочисленные побочные действия, препятствующие их широкому применению в адекватных дозах.
Недостаточная эффективность лечения паркинсонизма заставляет исследователей продолжить поиск новых лекарственных средств, которые самостоятельно или в комбинации с уже известными препаратами, позволили бы получить устойчивое улучшение состояния больных с БП. В настоящее время наиболее перспективным считается направление, связанное с разработкой новых АДР с высокой селективностью [9,16,18]. Из новых лекарственных средств этой группы внимание клиницистов привлекает Мирапекс (М) – прамипексола гидрохлорид, обладающий высокой селективностью в отношении подсемейства D2-дофаминовых рецепторов. В противоположность агонистам дофамина производным эрготамина, прамипексол стимулирует дофаминовые рецепторы, взаимодействуя с ними, а его селективность предполагает уменьшение побочных действий препарата.
Эффективность М при лечении БП оценивалась в период разработки препарата (семь рандомизированных контролируемых исследований) и в последующем в процессе клинического применения в различных лечебных учреждениях. Для оценки состояния больных использовалась Унифицированная шкала оценки БП и клинические наблюдения, отражавшие качество жизни или неврологический статус [17, 19, 20].
Установлено, что прием М улучшает двигательные функции во время периодов “включения” и “выключения”, отмечено статистически значимое снижение выраженности дискинезий, увеличение скорости ходьбы [20]. Оказалось, что препарат эффективен в отношении основных симптомов паркинсонизма: брадикинезии, ригидности и тремора. При этом следует выделить отчетливое положительное влияние прамипексола на тремор. Показано, что прамипексол благоприятно влияет на психоэмоциональное состояние больных: при длительном применении уменьшаются проявления тревожности, апатии, депрессии. Нейропсихиологические исследования выявили достоверное уменьшение выраженности когнитивных нарушений у больных, получавших М [9].
Электрофизиологическими исследованиями в экспериментах на животных показано, что М стимулирует дофаминовые рецепторы в полосатом теле [6, 21]. Прамипексол обладает нейропротективными свойствами: способен блокировать нарушения проницаемости пор митохондрий, стимулировать высвобождение нейротрофических факторов [11, 22].
М быстро всасывается из ЖКТ, достигая пика концентрации примерно через 2 часа. Абсолютная биодоступность препарата достигает 90%. Связывание с белками плазмы – около 15%. Величина конечного времени полувыведения составляет примерно 8 часов. Равновесная концентрация препарата достигается через 2 дня приема. С мочой выводится 90% введенной дозы. Клиренс прамипексола коррелирует с функцией почек. С возрастом период полувыведения препарата возрастает – у лиц старше 65 лет время полувыведения препарата возрастает на 40%.
Применение М может сопровождаться побочными эффектами наиболее значимые из которых: тошнота и ортостатическая гипотензия, запоры. Имеются указания на то, что назначение М у больных с дискинезиями, возникающими на фоне максимального действия леводопы, способствует усилению непроизвольных движений [7]. Очень редко при применении высоких доз – зрительные галлюцинации. Побочные эффекты дозозависимы и чаще отмечаются при быстром наращивании дозы.
Мирапекс выпускается в таблетках по 0,25 мг и 1,0 мг. Разнообразие дозировок необходимо для постепенного подбора терапевтической дозы. Рекомендуется начинать лечение с 0,375 мг в сутки (по 0,125 мг 3 раза в день). На второй неделе дозу можно увеличить до 0,25 мг 3 раза в день, затем каждую последующую неделю повышать на 0,75 мг в сутки до достижения устойчивого терапевтического эффекта. По литературным данным, осторожная адаптация к препарату позволяет выйти на достаточно большие суточные дозы – до 4,5-6,0 мг в сутки. Наши собственные наблюдения, основанные на применении М у 26 больных в возрасте от 62 до 79 лет с различными проявлениями паркинсонизма показали, что терапевтический эффект М проявляется на относительно небольших дозах (1,0-2,0 мг в сутки), однако частота и выраженность побочных действий препарата резко возрастает с увеличением дозы. По нашим данным наиболее частым побочным эффектом препарата была артериальная гипотония. При достижении суточной дозы в 2,0 мг относительная артериальная гипотония регистрировалась у каждого 4 больного. При лечении меньшими дозами (1,0-1,5 мг в сутки) побочные действия препарата существенного значения не имели и не требовали корректировки дозы. В некоторых случаях на фоне применения М не требовалось назначение антигипертензивных препаратов, которые ранее получали больные.
АДР используют в любых стадиях заболевания [8, 10, 11, 14]. Назначение М при тяжелом течении БП преследует цель усилить эффект проводимого лечения, уменьшить дозы леводопасодержащих препаратов, устранить побочные эффекты в виде непроизвольных движений и флюктуации (выраженных колебаний двигательных симптомов в течение дня). По некоторым данным применение М в комбинированной терапии позволяет снизить дозу леводопы на 30%. Положительный эффект при включении в программу лечения М отмечен у 95% больных. Улучшение при систематическом приеме обычно наблюдается на 2-3 неделе лечения.
Применение М в ранних стадиях болезни в качестве монотерапии показано в первую очередь молодым пациентам. При достаточной эффективности, особенно при дрожательных формах заболевания, М не требует постепенного повышения дозировок, оставляет резерв для более позднего назначения заместительной терапии. Антипаркинсонический эффект препарата у этой категории больных довольно стабилен – в 85% пациентов в течение года лечения не требовалось назначения других средств [8].
Таким образом, М является эффективным лекарственным средством для лечения любых форм паркинсонизма. Препарат может применяться как в комбинированной так и монотерапии. М обладает выраженным терапевтическим эффектом и требует осторожного подбора адекватной терапевтической дозы.
Список литературы Вы можете найти на сайте https://www.rmj.ru
Прамипексол –
Мирапекс (торговое название)
(Pharmacia)
Литература:
1.Антонов Ю.А., Мельникова Т.Ю., Сухорукова Н.Н. Особенности клинической картины и лечения болезни Паркинсона у больных пожилого и старческого возраста // Клиническая геронтология. -2000. -№7-8.-С. 85.
2.Вейн А.М., Голубев В.Л., Берзиныш Ю.Э. Паркинсонизм. Клиника, этиология, патогенез, лечение. -Рига: “Зинатне”, 1981. — 328 с.
З.Вендерова М.И., Садеков Р.А., Голубев В.Л. Эффективность новых форм мадопара при болезни Паркинсона // Журнал неврологии и психиатрии им. С.С.Корсакова. — 2000. -№ 12. -С. 46 — 48.
4.Гусев Е.И., Бурд Г.С., Никифоров А.С. Неврологические симптомы, синдромы, симптомокомплексы и болезни. -М.: Медицина, 1999.-880 с.
5.Левин О.С., Поцыбина В.В., Амосова Н.А. и др. Клинико-нейровизуализационное исследование больных с клинически диагностированной деменцией с тельцами Леви // Материалы Российского Конгресса “Новые технологии в неврологии и нейрохирургии на рубеже тысячелетий”. Ступино, 1999. -С. 116 — 117.
6.Левин О.С., Федорова Н.В., Смоленцева И.Г. и др. Влияние агонистов дофаминовых рецепторов на выраженность нейропсихиологических нарушений у больных с болезнью Паркинсона // Материалы Российского Конгресса “Новые технологии в неврологии и нейрохирургии на рубеже тысячелетий”. Ступино, 1999. -С. 115 — 116.
7.Нодель М.Р., Артемьев Д.В., Яхно Н.Н. Лечение двигательных нарушений на поздних стадиях болезни Паркинсона //Современные подходы к диагностике и лечению нервных и психических заболеваний (Материалы научной конференции Военно-медицинской академии). -С-П6.2000.-С.418.
8.Нодель М.Р., Артемьев Д.В., Яхно Н.Н. Эффективность дофаминового агониста мирапекса при болезни Паркинсона //Неврологический журнал. -1999. -№ 6. -С.45 — 49.
9.Смоленцева И.Г., Федорова Н.В. и др. Применение агонистов дофаминовых рецепторов на ранней стадии болезни Паркинсона // Современные подходы к диагностике и лечению нервных и психических заболеваний (Материалы научной конференции Военно-медицинской академии). -С-Пб, 2000. -С. 422.
10.Широков Е.А. Клиническая эффективность мирапекса при лечении больных паркинсонизмом// Проблемы инсульта: перспективные идеи и новые решения (Тезисы научно-практической конференции ГВГ им. Н.Н.Бурденко, 2000. — С. 198 — 200.
11.Шток В.Н., Федорова Н.В. Лечение паркинсонизма. -М.; 1997. -196с.
12.Яхно Н.Н. Современные подходы к лекарственному лечению болезни Паркинсона // Клиническая фармакология и терапия. -1994. -№ 3/4. -С. 92 — 97.
13.Benabid A.L., Pollak P. et al. Deep brain simultation in movement disoders // Acta Neurochir. -1994. -N 3. -P. 209 — 210.
H.Brundin P., Lindvall 0. Transplantation in Parkcinson’s disease //Restoration of Brain Function by tissue transplantation. -1993. -Vol. 5. -P. 18.
15.Costall В., Naylor R.J. The hypothesis of different dopamine receptor mechanisms // Life Sci. -1981. -Vol. 28. -P. 215 — 229.
16-Hubble J.P., Koller W. C. et al. Pramipexole in patients with early Parcinson’s disease // Clin Neuropharmacol. 1995. -Vol. 18. -P. 338 — 347.
17.Fedorova N.V., Stok V.N. Treatment of decompensations of Parkinson’s disease // Eur. Neuropsyhopharmacology. -2000. -Vol. 10. Sup. 2. -P. 4. 10.
18.Koller W. How accurately can Parkinson’s disease be diagnosed? // Neurolgy. -1992. -N 42. -(Sup. 1). -P. 4 — 5.
19.Levin O.S., Smolenzeeva N.V et. al. Dopamine agonist pramipexole ameliorates executive cognitive disfunction in patients with Parkinson’s disease // Eur. Neuropsyhopharmacology. -2000. -Vol. 10. Sup. 2. -P. 4. 09.
20-Lieberman A., Ranhosky., Korts D. Clinical evaluation of pramipexole in advanced Parkinson’s disease // Neurology. -1997. -Vol. 49. -P. 162- 163.
21.Mierau J., Schingnitz G. Biochimical and pharmacological studies on pramipexole, a potent and selective dopamine Da receptor agonist //Eur. J. Pharmacol. — 1992. -Sup. 215. -P. 161 — 170.
22-Molho E.S., Factor S.A. et. al. The use of pramipexole, a novel dopamine agonist, in advanced Parkinson’s disease //J. Neural. Transm. -1995. -Sup. 45. -P. 225 — 230.
23.Shannon K.M., Bennett J.P. et al. Efficacy of prampexole, a novel dopamine agonist, as monotherapy in mild to moderate Parkinson disease // Neurology. -1997. -Vol. 49. -P. 724 — 728.
Источник
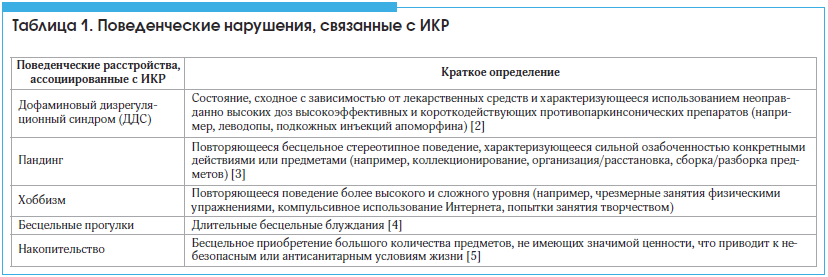
Нарушение импульсного контроля, или ИКР, – это состояние, которое характеризуется неспособностью противостоять искушению, побуждению или импульсу и является пагубным для пациента и его окружающих [1]. Пациенты с ИКР настойчиво занимаются определенным видом деятельности, который связан с поиском эмоционального вознаграждения, а также принимают неправильные решения без понимания возможных последствий выполняемых повторных действий. Подобные поведенческие расстройства возникают при БП примерно в 15% случаев и оказывают значительное влияние на качество жизни и повседневную активность, ухудшают межличностные отношения и увеличивают нагрузку на родственников и ухаживающих лиц. Термин «ИКР» обычно применяется по отношению к 4 видам импульсивного поведения, таким как игромания (гэмблинг), навязчивый шопинг, нарушение сексуального (гиперсексуальность) и пищевого (переедание) поведения. Близкими по проявлениям являются пандинг, дофаминовый дизрегуляционный синдром (ДДС), хоббизм и др. (табл. 1) [2–5]. 
ИКР имеют четкую связь с использованием агонистов дофаминовых рецепторов, в то время как ДДС преимущественно ассоциирован с быстродействующей высокоактивной дофамин-заместительной терапией, например, с приемом леводопы. Другие факторы риска ИКР представлены в таблице 2 [6–12]. 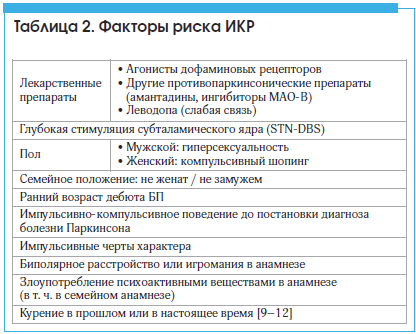
Эпидемиология ИКР и поведенческих нарушений, связанных с ИКР, при БП
Результаты нескольких проведенных к настоящему времени исследований свидетельствуют о том, что ИКР чаще встречаются у пациентов с БП, чем в популяции в целом или у здоровых лиц контрольной группы [13, 14]. Хотя в одном недавнем исследовании было показано обратное [15].
В кросс-секционных исследованиях БП с использованием формализованной оценки ИКР частота игромании составила 1,7–7,0%, импульсивного гиперсексуального поведения – 3,5%, импульсивного шопинга – 0,4–3,0% [2, 8, 16–18]. Импульсивное переедание также описывалось при БП, однако в первых работах по ИКР его частота не исследовалась [4, 19]. Крупнейшее исследование по изучению ИКР было проведено с участием 3090 пациентов с БП, получающих противопаркинсоническую терапию, в 46 центрах по лечению экстрапирамидных заболеваний в США и Канаде (исследование DOMINION) [20]. Для изучения частоты 4-х основных видов ИКР использовались полуструктурированное интервью, а также либо оценочная шкала, либо формальные диагностические критерии. Один или более вид ИКР был зарегистрирован у 13,6% пациентов (азартные игры в 5,0% случаев, импульсивное сексуальное поведение – в 3,5%, импульсивные покупки – в 5,7%, расстройство пищевого поведения – в 4,3%). 3,9% участников исследования имели 2 и более вида ИКР. Аналогичные данные о распространенности были зарегистрированы в крупном азиатском исследовании [21].
В небольшом российском одноцентровом контролируемом исследовании с участием 226 пациентов частота ИКР составила 15% [22].
ДДС и другие поведенческие расстройства, связанные с ИКР, не были так подробно изучены, как основные виды нарушений импульсного контроля. В исследовании, в котором впервые был описан феномен дофаминовой дизрегуляции, авторы зарегистрировали 15 случаев злоупотребления дофаминергическими препаратами. Однако в настоящее время отсутствуют данные поперечных исследований и кумулятивные показатели распространенности ДДС. Что касается пандинга, то в исследовании пациентов с БП, находящихся на терапии с высокой эквивалентной дозой леводопы, было отмечено, что критериям пандинга отвечают 14% больных [3], в то время как в еще более крупном исследовании БП, в котором для анализа не использовалась строго отобранная группа, распространенность пандинга составила 1,4% [23]. Важно отметить, что для пандинга, а также для некоторых ИКР (например, гиперсексуальности) не существует общепринятых диагностических критериев. Это может объяснять вариации показателей распространенности, опубликованные для многих из этих расстройств.
Нарушение импульсного контроля и противопаркинсонические препараты
Агонисты дофаминовых рецепторов
Уже в первых публикациях случаев ИКР и кросс-секционных исследований обсуждалась связь нарушений импульсного контроля при БП и дофаминергической терапии, особенно с агонистами дофаминовых рецепторов (АДР). В исследовании DOMINION [20] ИКР достоверно чаще встречались у пациентов, получающих АДР (17,1%), по сравнению с пациентами, не принимающими эту группу препаратов (6,9%). Лечение АДР при БП ассоциировалось с повышением шансов развития ИКР в 2–3 раза. У пациентов, получавших прамипексол и ропинирол (2 наиболее часто используемых АДР), распространенность ИКР была сопоставимой (17,7 и 15,5% соответственно). Прием этих неэрголиновых АДР второго поколения является наиболее значимым фактором риска развития ИКР. Их предпочтительная селективность в отношении D2-подобных рецепторов (рецепторы D3 и D2), которые локализационно связаны с мезокортиколимбической системой, вероятно, и объясняют относительно бо́льшую частоту ИКР при приеме этих препаратов. Была также отмечена связь между антипсихотиком арипипразолом, который является частичным агонистом рецептора D3, и развитием ИКР [24]. Что же касается роли дозы АДР, то в некоторых работах была показана четкая зависимость между дозой используемого АДР и развитием ИКР [25, 26]. Однако в исследовании DOMINION такая связь не наблюдалась. Существует предварительное доказательство того, что лечение АДР длительного действия (в виде пероральной формы [27], пластыря [27, 28] или подкожной помпы [29]) снижает риск развития ИКР, хотя для подтверждения этой гипотезы необходимы проспективные контролируемые исследования.
Леводопа, амантадины и ингибиторы МАО-В
В исследовании DOMINION использование леводопы, особенно в высоких дозах [20, 26], и амантадина [30] также было связано с развитием ИКР, однако в меньшей степени, чем лечение АДР. В более позднем исследовании также была подтверждена ассоциация между ИКР и использованием амантадина [31]. Кроме того, есть сообщение о независимой связи между ингибитором моноаминоксидазы-B (MAO-B), особенно разагилином, и ИКР при БП [32]. Наблюдения за пациентами, получающими интрадуоденальную инфузию геля леводопы-карбидопы, свидетельствуют о более низких показателях ИКР [33], что планируется подтвердить в длительных проспективных исследованиях.
Нарушение импульсного контроля и глубокая стимуляция головного мозга (DBS)
Связь между DBS и ИКР представляется сложной и противоречивой [34]. Ранние исследования показали, что DBS cубталамического ядра (STN DBS) ассоциируется с улучшением симптомов ИКР, что, вероятнее всего, объясняется значительным сокращением дофаминергической терапии, в частности, АДР, после операции [35, 36]. Тем не менее более поздние кросс-секционные и проспективные исследования продемонстрировали, что DBS сама по себе может вызывать или усугублять ИКР [37], хотя анализ таких случаев показывает, что многие из этих пациентов продолжали получать ту же или более высокую дозу дофаминергической терапии после операции [38]. При изучении нейропсихологических функций на фоне DBS пациенты с БП без ИКР в период с включенным стимулятором были более импульсивны в принятии решений [39]. Авторы другого исследования продемонстрировали, что DBS усиливает импульсивность, преждевременное необдуманное реагирование в конфликтных ситуациях, однако улучшает ингибирующий контроль в процессе самой реакции [40].
Ассоциации ИКР с психическими и другими немоторными симптомами БП
Известно, что при БП могут наблюдаться психические симптомы, в некоторой степени сходные по своим проявлениям с ИКР. Таким примером является обсессивно-компульсивное расстройство (ОКР), которое характеризуется повторением навязчивых и утомительных действий (например, счет, повторение слов, повторяющиеся проверки собственных действий), направленных на уменьшение тревоги, вызванной навязчивыми мыслями. ОКР при БП встречается более часто, чем в популяции, однако, в отличие от ИКР, не было выявлено ассоциации ОКР с противопаркинсоническими препаратами [41].
В крупном исследовании, проведенном с использованием метода «случай – контроль», сообщалось, что у пациентов с БП и ИКР, участвовавших до этого в исследовании DOMINION, были выявлены значительно более выраженные депрессия и тревога, ОКР, импульсивность и склонность к поиску новизны [42]. Другие исследователи также подтверждали ассоциацию между симптомами ИКР и депрессией [2, 43–45], тревожностью [46], психозом [26], ангедонией (неспособность испытывать удовольствие) [47] и алекситимией, которая проявляется трудностями в определении, описании, различении и идентификации собственных и чужих эмоций [48]. В недавно проведенном российском контролируемом одноцентровом исследовании БП в группе пациентов с ИКР была показана бо́льшая частота не только депрессии, но и нейротицизма [49]. У пациентов с ИКР при БП также отмечена бо́льшая распространенность нарушений сна, а именно худшая эффективность сна, дневная сонливость, синдром беспокойных ног [50, 51], худшие показатели по шкале сна PDSS [49]. Интересные данные были получены в недавнем исследовании, в котором была продемонстрирована сильная связь между симптомами ИКР и нарушением поведения в фазу сна с быстрым движением глаз, которая не зависела от типа принимаемого АДР, демографических или других клинических характеристик [52].
Нейрофизиология ИКР
Механизмы развития ИКР в настоящее время до конца не изучены. Изменения в функционировании дофаминергических путей, которые наблюдаются у пациентов с ИКР при БП, также были показаны и при отсутствии паркинсонизма у больных с расстройствами пищевого поведения, патологической страстью к азартным играм и злоупотреблением психоактивными веществами. Доказано, что в основе механизмов реализации импульсивного поведения лежит дисфункция мезокортиколимбической системы. Мезолимбический и мезокортикальный пути (два наиболее важных дофаминергических пути мозга) отвечают за процесс обучения на основе механизмов поощрения и за принятие исполнительных решений соответственно. Мезокортикальный путь регулирует принятие решений, связанных с оценкой возможной значимости и возможной ценности принятого решения. Мезокортиколимбическая дофаминергическая сеть связывает ключевые корковые и подкорковые области, особенно вентромедиальную префронтальную кору, вентральный стриатум, вентральный тегментум и амигдалу [53], и играет решающую роль в стимуляции и подкреплении обучения [54–56].
Провокация ИКР на фоне противопаркинсонической терапии обусловлена рецепторным профилем используемого препарата. По сравнению с леводопой большинство АДР первой линии имеют значительно более высокие соотношения активации рецепторов дофамина D3:D2 и D3:D1 [57]. D3-дофаминовые рецепторы сконцентрированы в вентральном стриатуме, бледном шаре, вентральном отделе скорлупы и медиальном дорзальном ядре таламуса, участвуют в медиации по мезолимбическим путям, связанным с механизмами поощрения/зависимости [58]. Напротив, рецепторы D1 и D2 в большей степени располагаются в дорзальном стриатуме и усиливают моторные и когнитивные функции через нигростриальные дофаминергические пути. Таким образом, можно предполагать, что используемые в настоящее время АДР будут непропорционально активировать мезолимбические, а не дорзальные двигательные пути и, следовательно, с большей вероятностью будут индуцировать ИКР по сравнению с леводопой и другими противопаркинсоническими препаратами.
Диагностика ИКР и методы оценки
Помимо клинического интервью для оценки симптомов ИКР при БП используются несколько скрининговых инструментов. Один из них – опросник MIDI (Minnesota Impulsive Disorders Interview) [59], который позволяет выявить некоторые виды ИКР, встречающиеся при БП. Другим инструментом являются опросник QUIP (Questionnaire for Impulsive-Compulsive Disorders in Parkinson’s Disease) [60] и версия этого инструмента в виде оценочной шкалы (QUIP-RS) [61], которая может использоваться как исследователем, так и самостоятельно пациентом. Кроме того, был разработан скрининговый опросник DDS-PC (Dopamine Dysregulation Syndrome-Patient and Caregiver Inventory) для оценки ДДС [62]. Широко используемая шкала MDS-UPDRS (Movement Disorder Society-Unified Parkinson’s Disease Rating Scale) включает в себя один пункт (игромания, гиперсексуальное поведение, хоббизм, пандинг и ДДС) [63], хотя исследования показали, что этот единственный вопрос не является валидным в качестве инструмента оценки ИКР [64]. Также ИКР учитываются в шкале Ardouin, представляющей собой полуструктурированное интервью из 21 пункта, которые позволяют оценить общее психологическое состояние, включая депрессию, гипоманиакальное или маниакальное состояние, тревогу, раздражительность, гиперэмоциональность, психотические симптомы, апатию, немоторные флуктуации, ИКР и связанные с ИКР поведенческие нарушения [65]. Наконец, для оценки тяжести проявлений ИКР была создана шкала PICS (Parkinson’s Impulse Control Scale), заполняемая клиницистом. Данный инструмент позволяет выявить как синдромальные, так и субсиндромальные формы ИКР и обладает высокой ретестовой надежностью и чувствительностью к изменениям [66].
Коррекция ИКР
Клинический опыт показывает, что ИКР могут исчезать после снижения дозы принимаемого АДР, особенно при полной отмене препарата, даже если для этого требуется компенсаторное увеличение дозы леводопы [20, 67]. Тем не менее многие пациенты не хотят или не могут прекратить терапию АДР либо из-за моторного ухудшения, либо из-за появления синдрома отмены АДР. Синдром отмены АДР – это сложный, нередко тяжелый синдром, который специфичен только для этой группы противопаркинсонических препаратов и поэтому не может быть смягчен леводопой или другими дофаминергическими средствами.
К настоящему времени накоплено очень мало данных клинических исследований по изучению влияния нейропсихиатрических препаратов или поведенческой терапии на ИКР при БП [6]. Клинические наблюдения показали противоречивые результаты в отношении ответа на различные классы лекарств, включая селективные ингибиторы обратного захвата серотонина, антидепрессант бупропион, антипсихотические средства, стабилизаторы настроения и противосудорожный препарат зонисамид. В небольшом плацебо-контролируемом исследовании сообщалось о пользе амантадина в качестве средства коррекции ИКР при БП [68], однако также следует отметить, что амантадин был ассоциирован с наличием ИКР, включая игроманию, в исследовании DOMINION [30], а также в недавно опубликованной небольшой серии клинических случаев [31].
Антагонисты опиоидных рецепторов (мю и каппа), такие как налтрексон и налмефен, продемонстрировали преимущества в некоторых исследованиях при лечении игромании, гиперсексуального поведения, алкоголизма и импульсивных покупок у пациентов без БП [69, 70]. При БП небольшое рандомизированное плацебо-контролируемое клиническое исследование налтрексона для коррекции ИКР не подтвердило эффективности в первичной конечной точке (по оценке клинициста), но выявило статистически значимое преимущество для налтрексона при заполнении самим пациентом оценочной шкалы тяжести симптомов ИКР [71].
В наблюдательном исследовании было показано, что при терапии с помощью интрадуоденальной инфузии геля леводопы-карбидопы существующие до начала лечения ИКР могут уменьшаться или полностью исчезать [72]. А в открытом сравнительном исследовании геля леводопы-карбидопы и апоморфина на фоне инфузии леводопы не было отмечено ни одного нового случая ИКР [73].
Что касается нефармакологических методов лечения, то в рандомизированном контролируемом исследовании, в котором изучалась когнитивная поведенческая терапия (КПТ), было показало ее преимущество в группе с использованием КПТ по сравнению с контрольной группой, в которой КПТ не применялась [74]. В очень небольшой серии случаев сообщалось о временном улучшении проявлений пандинга на фоне повторяющейся транскраниальной магнитной стимуляции дорсолатеральной префронтальной коры [75].
При выявлении ИКР при БП возможный алгоритм работы с пациентом представлен на рисунке 1. 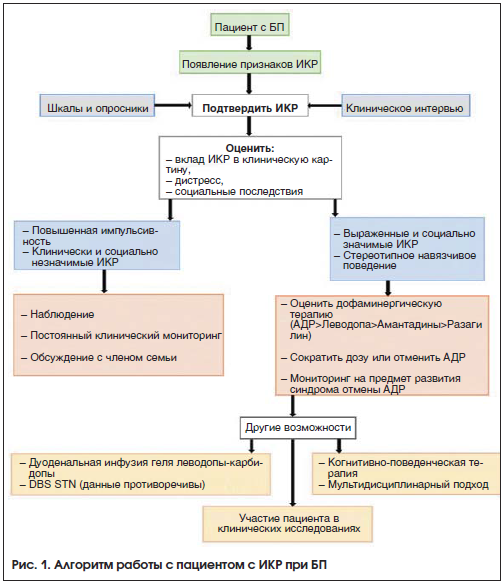
Заключение
Нарушения импульсного контроля при БП представляют собой набор поведенческих расстройств, которые в некоторой степени напоминают злоупотребление психоактивными веществами среди населения в целом. Механизмы развития ИКР остаются неясными, однако основополагающая роль приписывается дофаминергической дисфункции системы вознаграждения в головном мозге. Ряд клинических исследований подтвердил тесную связь ИКР с приемом АДР, хотя также существует более слабая связь с леводопой и некоторыми другими дофаминергическими препаратами. Однако существуют и другие факторы риска развития ИКР при БП, такие как особенности личности, более молодой возраст дебюта БП, мужской пол, импульсивно-компульсивное поведение в анамнезе и др. На клиническом приеме выявление ИКР у пациента с БП является критически важным, поскольку поведенческие нарушения могут приводить к серьезным личным, семейным, психосоциальным, финансовым и медицинским последствиям. Диагностика ИКР возможна с помощью проведения простого клинического интервью, однако полезными могут быть скрининговые опросники и шкалы. Коррекция клинически значимых ИКР требует медленного снижения дозы АДР и нейропсихологической, а иногда и нейропсихиатрической поддержки. Более того, существует вероятность постоянного присутствия ИКР в клинической картине БП, поскольку пациенты могут не прекратить терапию АДР из-за развивающегося на фоне уменьшения дозы двигательного ухудшения или развития синдрома отмены АДР.
Источник
